Obecný vzorec aminů. Vlastnosti a struktura aminů
Organické báze - tento název se často používá v chemii pro sloučeniny odvozené od amoniaku. Atomy vodíku v molekule jsou nahrazeny uhlovodíkovými radikály. Mluvíme o aminech - sloučeninách, které opakují chemické vlastnosti čpavku. V našem článku se seznámíme s obecným vzorcem aminů a jejich vlastností.
Molekulární struktura
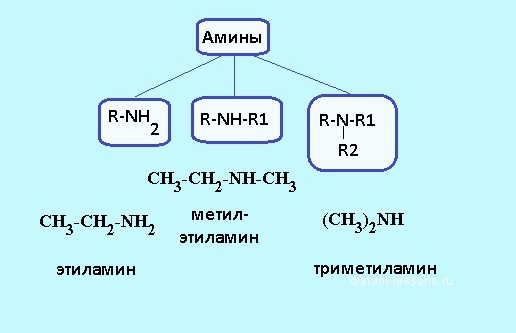
V závislosti na tom, kolik atomů vodíku jsou nahrazeny uhlovodíkovými zbytky, jsou rozlišeny primární, sekundární a terciární aminy. Například methylaminem je primární amin, ve kterém byla částice vodíku nahrazena skupinou -CH3. Strukturní vzorec aminů je R-NH2, může být použit k určení složení organické hmoty. Příkladem sekundárního aminu může být dimethylamin, který má následující formu: NH2-NH-NH2. V molekulách terciárních sloučenin jsou všechny tři atomy vodíku amoniaku nahrazeny uhlovodíkovými radikály, například trimethylamin má vzorec (NH2) 3 N. Struktura aminů ovlivňuje jejich fyzikální a chemické vlastnosti.
Fyzikální charakteristika
Celkový stav aminů závisí na tom, co molární hmotnost radikály. Čím menší je, tím nižší je specifická hmotnost látky. Aminy nižší třídy jsou představovány plyny (například methylamin). Mají výrazný zápach amoniaku. Střední aminy jsou mírně vonící kapaliny a sloučeniny s velkým množstvím uhlovodíkových radikálů jsou pevné látky bez zápachu. Rozpustnost aminů závisí také na hmotnosti radikálu: čím je větší, tím horší se látka rozpouští ve vodě. Tak struktura aminů určuje jejich fyzický stav a vlastnosti.
Chemické vlastnosti
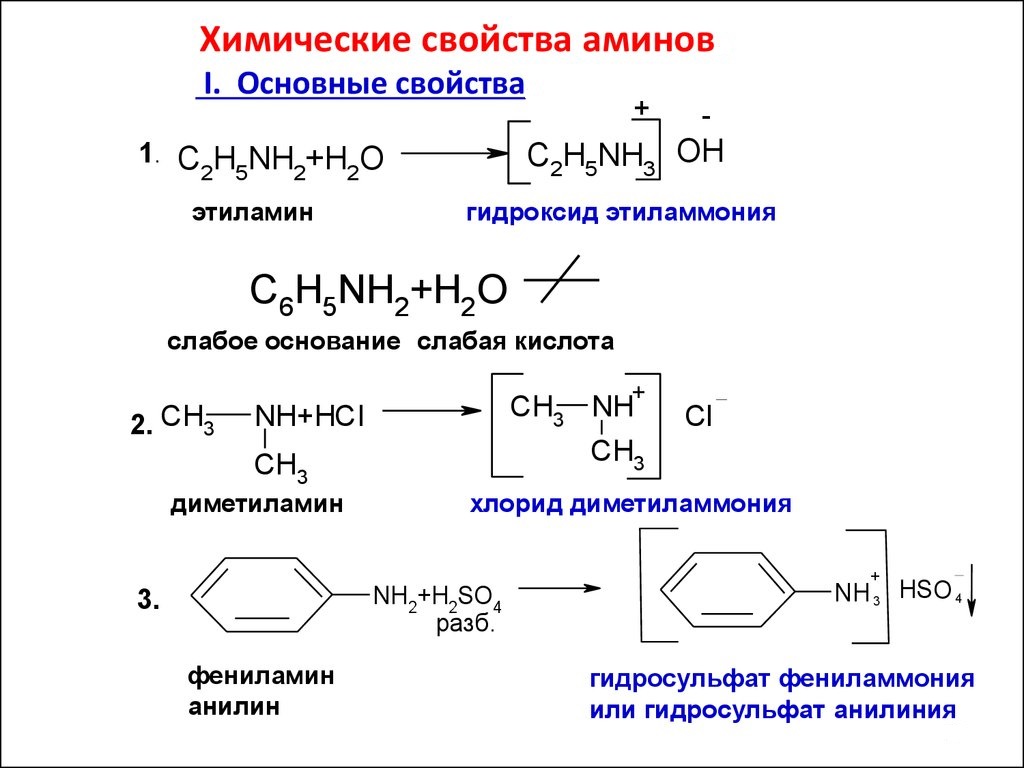
Vlastnost látek závisí hlavně na přeměnách aminoskupiny, ve které je vedoucí úloha přidělena jejímu osamělému elektronovému páru. Tak jako organické látky aminy jsou deriváty amoniaku, jsou schopné reakce charakteristické pro NH3. Například sloučeniny se rozpustí ve vodě. Výrobky této reakce budou látky vykazující vlastnosti hydroxidů. Například methylamin, jehož atomová kompozice odpovídá obecnému vzorci nasycených aminů R-NH2, tvoří sloučeninu s vodou - methylhydroxidem:
CH3-NH2 + H20 = [CH3-NH3] OH
Organické báze interagují s anorganickými kyselinami a ve výrobcích je zjištěna sůl. Tak, methylamin s kyselinou chlorovodíkovou poskytuje methylamoniumchlorid:
CH3-NH2 + HCl -> [CH3NH3] Cl
Reakce aminů, jejichž obecný vzorec je R-NH2, s organické kyseliny jsou nahrazeny nahrazením atomu vodíku aminoskupiny komplexním aniontem zbytku kyseliny. Jsou nazývány alkylační reakce. Stejně jako při reakci s kyselinou dusičnou mohou acylové deriváty tvořit pouze primární a sekundární aminy. Trimetylamin a jiné terciární aminy nejsou schopny takové interakce. Dále dodáváme, že alkylace v analytické chemii se používá k oddělení směsí aminů, slouží také kvalitativní odpověď na primární a sekundární aminy. Mezi cyklickými aminy je důležitý anilin. Z nitrobenzenu se extrahuje redukcí vodíku v přítomnosti katalyzátoru. Anilin je surovina pro výrobu plastů, barviv, výbušnin a drog.

Funkce terciárních aminů
Terciární deriváty amoniaku se liší v jejich chemických vlastnostech z jednozáložkových nebo dvou-substituovaných sloučenin. Například mohou interagovat s halogenovými deriváty nasycených uhlovodíků. V důsledku toho se vytvářejí tetraalkylamoniové soli. Oxid stříbrný reaguje s terciárními aminy, zatímco aminy se převádějí na hydroxidy tetraalkylamonné, které jsou silné báze. Mohou se tvořit kyseliny aprotické, jako je fluorid boritý, s trimethylaminem komplexních sloučenin.
Kvalitativní test pro primární aminy
Kyselina dusitá může sloužit jako činidlo, pomocí něhož lze detekovat jeden nebo dva substituované aminy. Vzhledem k tomu, že neexistuje ve volném stavu, aby se získala v roztoku, nejprve provést reakci mezi zředěnou kyselinou chloridovou a dusitanem sodným. Poté přidáme rozpuštěný primární amin. Složení jeho molekul lze vyjádřit obecným vzorcem aminů: R-NH 2. Tento proces je doprovázen vzorkem molekul nenasycených uhlovodíků, které lze stanovit reakcí s bromovou vodou nebo roztokem manganistanu draselného. Izonitrilová reakce může být považována za kvalitativní. Primární aminy interagují s chloroformem v prostředí s nadměrnou koncentrací hydroxylových aniontů. Výsledkem je tvorba isonitrilu s nepříjemným specifickým zápachem.

Charakteristiky reakce sekundárních aminů s kyselinou dusitou
Technologie pro výrobu činidla HNO 2 je popsána výše. Potom se do roztoku obsahujícího reakční činidlo přidá organický derivát amoniaku obsahující dva uhlovodíkové zbytky, například diethylamin, jehož molekula odpovídá obecnému vzorci sekundárních aminů NH2-R-NH2. V reakčních produktech nalezneme nitrosloučeninu: N-nitrosodiethylamin. Pokud se působí chloridem, sloučenina se rozloží na chloridovou sůl výchozího aminu a nitrosylchloridu. Dále dodáváme, že terciární aminy nejsou schopné reagovat s kyselinou dusitou. To je vysvětleno následující skutečností: kyselina dusitá patří mezi slabé kyseliny a její soli při interakci s aminy obsahujícími tři uhlovodíkové zbytky jsou zcela hydrolyzovány ve vodných roztocích.
Způsoby, jak se dostat
Aminy, jejichž obecný vzorec je R-NH2, mohou být získány redukcí sloučenin obsahujících dusík. Například to může být redukce nitroalkanů v přítomnosti katalyzátoru - kovového niklu - při zahřátí na +50 ° C a při tlaku až 100 atm. Nitroetan, nitropropan nebo nitromethan se v důsledku tohoto procesu převedou na aminy. Látky této třídy mohou být také získány redukcí sloučenin nitrilové skupiny vodíkem. Tato reakce probíhá v organických rozpouštědlech za přítomnosti niklového katalyzátoru. Pokud se jako redukční činidlo používá kovový sodík, v tomto případě se proces provádí v alkoholovém roztoku. Uvádíme jako příklady další dvě metody: aminace halogenalkanů a alkoholů.
V prvním případě se vytvoří směs aminů. Aminace alkoholů se provádí následovně: směs methanolu nebo ethanolu s amoniakem se vede přes oxid vápenatý, který působí jako katalyzátor. Výsledné primární, sekundární a terciární aminy mohou být obvykle odděleny destilací.
V našem článku jsme studovali strukturu a vlastnosti organických sloučenin obsahujících dusík - aminy.