Co je fluorid? Vlastnosti chemického prvku
Fluor je nejlehčí člen halogenové rodiny, prvky skupiny 17 (VIIA) periodické tabulky. Do této skupiny patří také chlor, brom, jod a atstatin.
Stručný popis
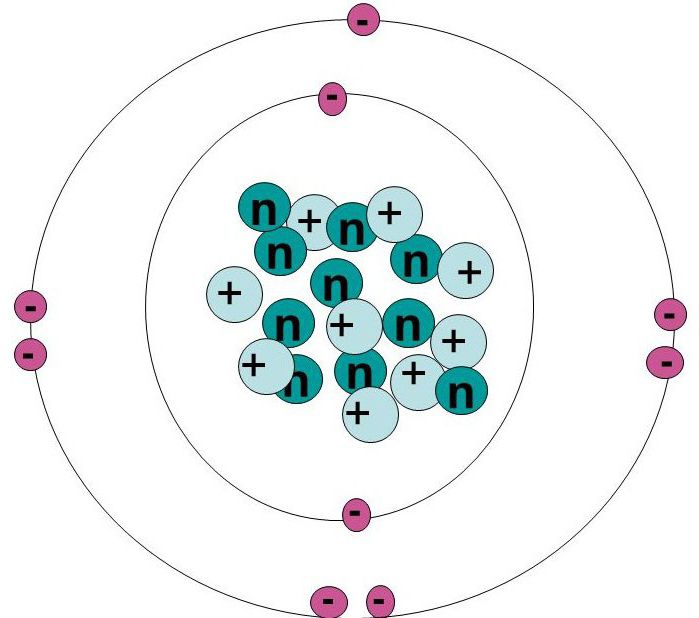
9 fluorových elektronů tvoří konfiguraci 1s 2 2s 2 2p 5 . V naplněném vnitřním plášti jsou 2 elektrony a 7 na vnější straně, což zanechává 1 volný prostor.
Struktura fluoru z něj činí nejaktivnější chemický prvek, který reaguje s téměř všemi látkami. Při vysokých teplotách a tlacích dokonce reaguje s vzácnými plyny, ačkoli obvykle prvky skupiny 18 (VIIIA), také známé jako inertní plyny, nereagují s jinými látkami.
Fluor byl objeven v roce 1886 francouzským chemikem Henriem Moissanem (1852-1907). Získal plyn a prošel elektrickým proudem přes fluorovodík (H 2 F 2 ).
Spotřebitelé nejvíce vědí o fluoru kvůli svým dvěma sloučeninám. Diatomický plyn se používá k výrobě fluoridů, sloučenin, které od padesátých let minulého století. část zubních past. Jsou účinné při prevenci kazu, takže jsou dokonce přidávány do městských vodních systémů.
Další skupinou sloučenin fluoru jsou chlorfluorované uhlovodíky (CFC). Již řadu let jsou velmi oblíbené jako aerosolové pohonné hmoty. Nicméně CFC v horní atmosféře reagují s ozonem (O 3 ). Ozonová vrstva filtry škodlivé ultrafialové záření Slunce, které je elektromagnetickým zářením s vlnovými délkami kratšími než fialové spektrum a proto s vyšší energií než s viditelným světlem. Proto je výroba CFC zakázána.

Historie objevů
Chemie byla vždy nebezpečná věda. A časná chemie byla smrtící zaměstnání. Vědci pracovali s látkami, o kterých věděli jen málo. Objev nových sloučenin a prvků často měl tragické následky.
Fluor je extrémně nebezpečnou látkou. Snaží se izolovat prvek, chemici dostali hrozné popáleniny a dokonce zemřeli. Fluorový plyn poškozuje měkké tkáně dýchacího ústrojí.
Na počátku léta 1500, německý vědec George Agricola (1494-1555) popisoval fluorid, který nazýval "fluorit". Toto slovo pochází z latinského slovesa fluere ("flow"). Agricola tvrdila, že křemelina přidaná do roztavených kovových rud z nich činí tekutější, což usnadňuje práci s nimi. Německý vědec nevěděl, že tento minerál obsahuje fluorid ve formě fluoridu vápenatého (CaF 2 ).
Fluorit byl předmětem intenzivního studia. V roce 1670 objevil německý sklář Heinrich Schwanhard, že směs křemíku a kyseliny tvoří látku, která může být použita k vylévání skla, tj. Chemická reakce k vytvoření matného povrchu. Tento proces se používá k aplikaci vzorků na sklo a vytváření přesných vědeckých měřicích přístrojů.
V roce 1771 našla nová leptaná substance švédský chemik Carl Wilhelm Scheele (1742-86). Detailně popsal vlastnosti kyseliny fluorovodíkové (HF). Práce Scheele přispěla k intenzivnímu studiu této sloučeniny.
Lékárníci hledali způsoby, jak rozložit kyselinu fluorovodíkovou do svých složek. Předpokládali, že musí být objeven prvek, který nikdy předtím neviděli. Nicméně nevěděli, jaký fluorid je a jak nebezpečný je. Mnoho vědců kyseliny fluorovodíkové se stalo zdravotně postiženým dýcháním plynného HF. Jeden z nich, belgický chemik Paulin Louyet (1818-1850), zemřel na účinky této látky.

V roce 1888 byl problém vyřešen. Francouzský chemik Henri Moissan získal roztok kyseliny fluorovodíkové (HF) v fluoridu draselném (KHF 2 ). Pak ho ochladil na -23 ° C a prošel elektrickým proudem. Na jednom konci přístroje se objevil plyn. Nový chemický prvek se nazývá fluor, odvozený od latinského názvu kazivce. Slovo "fluór" v roce 1810 navrhl André Ampere. Je to řecký původ a znamená "zničení".
Fyzikální vlastnosti
Fluor je bledě žlutý plyn o hustotě 1,695 g / l. To je asi 1,3 krát hustší než vzduch. Fluor se dostane do kapalného stavu při -188,13 ° C a pevný při -219,61 ° C. Látka má silný specifický zápach, podobný zápachu chlóru a ozónu, který lze pozorovat i ve velmi malých množstvích - až 20 dílů na miliardu. Tato vlastnost je velmi užitečná pro ty, kteří pracují s fluorem - plyn může být detekován a vyhnout se škodlivým účinkům při vstupu do místnosti.
Chemické vlastnosti
Vazebná energie F2 je mnohem nižší než energie Cl2 nebo Br2 a je totožná s peroxidem vodíku. Vysoká elektronegativita způsobuje disociaci, vysokou reaktivitu a silné chemické vazby mezi fluorem a jinými atomy. Snadno vstoupí do kontaktu s jakýmkoli jiným prvkem, s výjimkou helia, neonu a argonu. Fluor reaguje s většinou sloučenin, často velmi aktivně. Například při míchání s vodou dojde k výbuchu. Z těchto důvodů je třeba v laboratoři věnovat zvláštní pozornost.
Být v přírodě
Ve volném stavu nebyl nalezen prvek fluor. Nejběžnějšími minerály obsahujícími fluor jsou křemen, fluorapatit a kryolit. Apatit je složitý minerál obsahující především vápník, fosfor a kyslík, obvykle v kombinaci s fluorem. Kryolita je také známá jako Grónsko, protože Grónsko je jediným komerčním zdrojem tohoto minerálu. Skládá se převážně z fluoridu sodného Na 3 ALF 6 .
Hlavními světovými výrobci surovin pro výrobu fluoru jsou Čína, Mexiko, Mongolsko a Jižní Afrika. Spojené státy jednou těžily malé množství kazivce, ale poslední důl byl uzavřen v roce 1995 a země začala dovážet fluoridové rudy.
V zemské kůře je bohatý fluor. Jeho podíl se odhaduje na cca 0,06%. To dělá to asi 13. nejvíce obyčejný prvek v kůře, který zhruba odpovídá obsahu manganu nebo bária.
Co je fluor-19?
Chemický prvek má pouze jeden přirozený izotop - 19 F. Izotopy představují jinou formu prvku, který se liší v hmotnostním počtu, což odpovídá počtu protonů a neutronů v jádru atomu. Počet prvků určuje počet protonů, ale počet jeho neutronů se může lišit. Navíc každá variace je izotop. Fluor-19 má velký gyromagnetický poměr a výjimečnou citlivost na magnetické pole. Jelikož je to jediný stabilní izotop, používá se při zobrazování magnetickou rezonancí.
Známých 17 radioaktivních izotopů fluoru. Z nich nejstabilnější je 18 F. Jeho jádra jsou rozdělena s poločasem 109,77 minut. 18 F se někdy používá pro lékařský výzkum. Jednou v těle se fluorid pohybuje hlavně do kosti. Jeho přítomnost může být detekována radiací, které vydává. Vzor záření umožňuje stanovit stav kostní tkáně. Fluorin-18 se někdy používá podobně jako u mozkových funkcí.

Příjem, určování, použití
Průmyslová výroba fluoridu je založena na Moissanově metodě. Elektrický proud 8-12 V prochází skrz směs HF a KF za vzniku H2 a F2.
Fluor je určen v roztoku potenciometrií, tj. Měřením potenciálu elektrody. Membrána elektrody je vyrobena z monokrystalického LaF 3 dopovaného difluoridy drahých kovů.
V elementárním stavu je fluor použit relativně málo. On je příliš aktivní pro to. Používá se v raketovém palivu, zajišťuje spalování, jako je kyslík. Nejvíce poptávka v závazném stavu. Fluoridy jsou sloučeniny fluoru a kovu. Příklady jsou fluorid sodný (NaF), vápníku (CaF 2 ) a cínu (SnF 2 ).
Ochrana zubů
Fluorid je součástí zubních past. Studie ukázaly, že malé množství fluoridu může pomoci snížit incidence kazu. Jsou uloženy jako vytvoření nového materiálu zubů, který je silný a odolný vůči ničení.
V některých městech se do systému přívodu vody přidává fluorid. Tímto způsobem úřady doufají, že zlepší zubní zdraví občanů. Nejvíce se těší mladí lidé, jejichž zuby se stále rozvíjejí. Proces přidávání fluoridu do vodního systému se nazývá fluoridace. Příliš mnoho fluoridu ve vodě vede ke ztmavnutí zubů a vzniku trvalých skvrn.

Dobré nebo špatné?
Někteří se obávají dlouhodobých účinků fluoridu na veřejné zásobování vodou na veřejné zdraví. Ukazují, že fluor je smrtelný jed a že jeho sloučeniny mohou být také toxické. To je pravda, F 2 je velmi nebezpečný, ale vlastnosti sloučenin se liší od jejich složek. Takže úzkost je neopodstatněná.
Silný charakteristický zápach fluoru umožňuje detekovat jeho únik a zabránit kontaktu s ním.
Fluoridy jsou obvykle nebezpečné pouze ve velkých dávkách. Jejich koncentrace ve vodě je obvykle velmi malá, jen několik ppm. Většina odborníků z oboru stomatologie a zdravotní péče se domnívá, že takový fluorid je užitečný a nepředstavuje hrozbu pro lidské zdraví.
Teflon
Náhodné objevy hrají velkou roli ve vědeckém výzkumu. Příklad úspěšné a velmi výnosné havárie může sloužit jako materiál Teflon - plast, vyráběný firmou DuPont Chemical Company. Stala se důležitým komerčním produktem, protože na něj téměř nic nepřichází. Dnes mají všichni smažitelnou pánvi, jejíž vnitřní povrch je pokryt tímto materiálem, jelikož se jídlo během vaření nelepí. Teflonové pánve navíc nepotřebují rostlinný ani živočišný olej.

Teflon byl náhodou objeven v roce 1938 chemikou u společnosti DuPont, Roy Plunkett (1911-1994), který vyvíjel chlorfluoruhlovodíky (CFC). Chtěl vědět, co se stane, pokud smíchá tetrafluorethylen (TFE) C 2 F 4 s kyselinou chloristou. Při pokusu instaloval zařízení tak, aby plynný TPV proudil do nádrže HCl. Ale když otevřel ventil, nic se nestalo. Plunkett by mohl plavidlo odhodit, ale ne. Místo toho ho chemik řežil a zjistil, že TFE polymeruje do jedné hmoty, tj. Tisíců jednotlivých molekul TFE spojených do jedné, nazývaných polytetrafluorethylen (PTFE).
Plunkett vyškrábal výsledný bílý prášek a poslal ho vědcům společnosti DuPont, kteří vyvíjeli umělá vlákna. Studovali nový materiál a našli své nelepivé vlastnosti. Brzy začal vývoj nových aplikací pro nový materiál.
Společnost DuPont zaregistrovala ochrannou známku Teflon v roce 1945 a o rok později vydala své první výrobky. Od té doby se nelepivá povrchová úprava stala běžnou součástí kuchyňského náčiní, teflon se objevil ve sprejích na pečení a jako ochrana skvrn pro textil a textil.
Chlorfluorované uhlovodíky
Prvek fluoru se také používá při výrobě freonu. Chlorofluorokarbóny byly objeveny v pozdních dvacátých letech americkým chemickým inženýrem Thomasem Midgli Jr. (1889-1944). Tyto sloučeniny mají řadu zajímavých vlastností. Jsou velmi stabilní a nerozkládají se při použití v průmyslu. Freon byl široce používán v klimatizačních systémech av chladničkách, jako čisticí prostředky, v aerosolích a jako součást specializovaných polymerů. Produkce CFC se zvýšila z 1 tisíc tun v roce 1935 na více než 300 tisíc tun v roce 1965 a 700 tisíc tun v roce 1985.
Avšak do poloviny osmdesátých let. Studie ukázaly, že tyto sloučeniny způsobují poškození ozonové vrstvy, která je ve výšce 20 až 50 km nad zemským povrchem a je důležitá pro život na naší planetě, protože ji chrání před škodlivým ultrafialovým zářením ze slunce. To vedlo k postupnému zastavení výroby a používání ve většině zemí světa. Nové, bezpečné pro materiály Země se objevily a nahrazují CFC.

Ochrana všech živých věcí
CFC bývaly populárními průmyslovými chemikáliemi, protože je těžké je zničit. Dlouhodobě se tyto látky používají v klimatizačních zařízeních a chladničkách jako prostředek, který přenáší teplo na vnější stranu. Vědci si však uvědomili, že CFC představují hrozbu pro ozonovou vrstvu, protože jsou zničeny. Jak je to možné? Vždy existuje možnost úniku chladiva z klimatizačních jednotek a ledniček. CFC jsou plyny nebo kapaliny, které se snadno odpařují a vystupují do atmosféry. Nakonec dosáhnou ozonové vrstvy.
V této výšce se pod vlivem intenzivního slunečního záření zničí CFC. Molekula, která je na zemi stabilní, ztrácí tuto kvalitu ve vysoké nadmořské výšce. Když je zničen, uvolní se atom chloru, který může reagovat s O3. Ozón filtruje škodlivé záření slunce, což způsobuje těžké spáleniny a rakovinu kůže. Kyslík to není schopen. Čím více CFC v atmosféře, tím více atomů chloru. Čím více atomů chloru, tím méně molekul ozonu a více ultrafialového záření dosáhne zemského povrchu, což má negativní dopad na lidské zdraví.
V polovině osmdesátých let bylo zjištěno, že CFC poškozují ozónovou vrstvu. To přesvědčilo politiky, aby zakázali další výrobu a používání chlorfluoruhlovodíků.
Dopad na lidské zdraví
Fluor je chemický prvek, který může být velmi nebezpečný. Vdechování v malých množstvích způsobuje silné podráždění dýchacích cest (nos, krk a plic). Ve velkém množství to může vést k smrti. Nejvyšší přípustná dávka fluoridu je 1 díl na milion částí vzduchu po dobu 8 hodin.