Co je číslo Avogadro?
Avogadro právo se stal skutečným průlomem v teoretické chemii a přispěl k tomu, že se hypotetické odhady změnily na velké objevy v oblasti plynové chemie. Předpoklady chemiků získaly přesvědčivé důkazy ve formě matematických vzorců a jednoduchých vztahů a výsledky experimentů nyní umožnily dalekosáhlé závěry. Kromě toho získal italský badatel kvantitativní popis počtu strukturních částic chemického prvku. Číslo Avogadro se následně stalo jednou z nejdůležitějších konstant v moderní fyzice a chemii. 
Zákon volumetrických vztahů
Čest, že je objevitelem plynových reakcí, patří mezi Gay-Lussac, francouzský vědec z konce 18. století. Tento výzkumník dal světu známý zákon, který řídí všechny reakce spojené s expanzí plynů. Gay-Lussac měřil objemy plynů před reakcí a objemy, které byly získány v důsledku chemické interakce. V důsledku experimentu vědec uzavřel závěr známý jako zákon jednoduchých volumetrických vztahů. Její podstatou je, že objemy plynů před a po sobě navzájem souvisejí jako celé malé počty.
Ad
Například interakce plynných látek, odpovídající například jednomu objemu kyslíku a dvěma objemům vodíku, vede k dvěma objemům parní vody a tak dále. 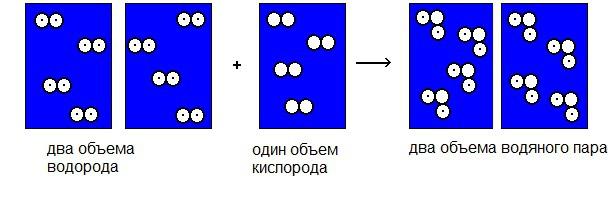
Zákon Gay-Lussac je platný, pokud se všechna měření objemů vyskytnou při stejném tlaku a teplotě. Tento zákon byl pro italského fyziku Avogadra velmi důležitý. Vedl ho, odvozil svůj předpoklad, který měl dalekosáhlé důsledky v chemii a plynové fyzice, a vypočítal Avogadrovo číslo.
Italský vědec
Jeho vědecká činnost Amedeo Avogadro Začal studiem elektrochemických jevů. V roce 1803 představil svou práci na teorii elektrochemických jevů vlastním Turínské akademii. Později se jeho myšlenky zajímaly o Ampere, který je rozvinul do plnohodnotné fyzické teorie podporované četnými experimenty. Zajímat se o všechny nejnovější objevy ve fyzice a chemii, Avogadro čelil problému poměru objemů různých látek a počtu molekul obsažených v nich. V 1811 vědec formuloval návrh, který vysvětlil zákon Gay-Lussac a dal nový impuls vysvětlení mnoha chemické reakce.
Ad
Avogadro právo
V roce 1811 dospěl Avogadro k závěru, že ve stejných objemech libovolných plynů při konstantních hodnotách teploty a tlaku obsahuje stejný počet molekul.  Tento zákon, později jmenovaný na počest italského vědce, zavedl do vědy myšlenku nejmenších částic substance - molekul. Chemie byla rozdělena na empirickou vědu, jaká byla a věda, která působí v kvantitativních kategoriích, která se stala. Avogadro zvláště zdůraznil skutečnost, že atomy a molekuly nejsou stejné a že atomy tvoří stavební bloky pro všechny molekuly.
Tento zákon, později jmenovaný na počest italského vědce, zavedl do vědy myšlenku nejmenších částic substance - molekul. Chemie byla rozdělena na empirickou vědu, jaká byla a věda, která působí v kvantitativních kategoriích, která se stala. Avogadro zvláště zdůraznil skutečnost, že atomy a molekuly nejsou stejné a že atomy tvoří stavební bloky pro všechny molekuly.
Zákon italského výzkumníka umožnil dospět k závěru o počtu atomů v molekulách různých plynů. Například po uzavření zákona Avogadro potvrdil předpoklad, že molekuly takových plynů jako je kyslík, vodík, chlor a dusík se skládají ze dvou atomů. Také bylo možné stanovit atomové hmoty a molekulové hmotnosti prvků složených z různých atomů.
Ad
Atomová a molekulová hmotnost
Při výpočtu atomové hmotnosti prvku se nejprve odebrala hmotnostní hmotnost vodíku jako jednotka měření jako nejlehčí chemická látka. Ale atomová hmotnost mnoha chemikálií se vypočítá jako poměr jejich kyslíkových sloučenin, tj. Poměr kyslíku a vodíku byl vzat jako 16: 1. Tento vzorec byl poněkud nevhodný pro měření, takže hmotnost uhlíkového izotopu, nejběžnější látka na zemi, byla přijata jako standard pro atomovou hmotnost.
Princip stanovení hmotností různých plynných látek v molekulárním ekvivalentu je založen na zákonu Avogadro. V roce 1961 byl přijat jediný referenční systém relativních atomových hodnot, který byl založen na konvenční jednotce rovnající se 1/12 části hmotnosti jednoho uhlíkového izotopu 12 C. Zkrácený název atomové jednotky hmoty je Amu. Podle tohoto stupnice je atomová hmotnost kyslíku 15,999 amu a uhlík je 1,0079 amu. Tak vznikla nová definice: relativní atomová hmotnost je hmotnost atomu látky vyjádřená v amu.
Hmotnost molekuly látky
Každá látka se skládá z molekul. Hmotnost takové molekuly je vyjádřena v ae.u.m, tato hodnota se rovná součtu všech atomů, které tvoří její složení. Například molekula vodíku má hmotnost 2,0188 amu, tj. 1,0079 x 2 a molekulární hmotnost vody může být vypočítána z jejího chemického vzorce H20. Dva atomy vodíku a jediný atom kyslíku dávají celkem 18 , 0152 amu
Ad
Hodnota atomové hmotnosti pro každou látku se nazývá relativní molekulová hmotnost.
Až donedávna se místo výrazu "atomová hmotnost" používá termín "atomová hmotnost". V současné době se nepoužívá, ale stále se nachází ve starých učebnicích a vědeckých pracích.
Jednotkové množství látky
Spolu s jednotkami objemu a hmotnosti používá chemie speciální měřítko množství látky, nazývané mol. Tato jednotka zobrazuje množství látky, která obsahuje tolik molekul, atomů a dalších strukturních částic, jak jsou ve 12 gramech uhlíku izotopu 12 C. Při praktickém použití molu látky je třeba brát v úvahu, které jednotlivé částice prvků jsou míněny - ionty, atomy nebo molekuly. Například mól iontů H + a molekul H2 je zcela odlišná opatření.
V současné době se měří velkou přesností množství látky v mólu látky.
 Praktické výpočty ukazují, že počet strukturních jednotek na mol je 6,02 x 10 23 . Tato konstanta se nazývá Avogadro číslo. Tato chemická hodnota, pojmenovaná podle italského vědce, udává počet strukturních jednotek v molě jakékoli látky, bez ohledu na její vnitřní strukturu, složení nebo původ.
Praktické výpočty ukazují, že počet strukturních jednotek na mol je 6,02 x 10 23 . Tato konstanta se nazývá Avogadro číslo. Tato chemická hodnota, pojmenovaná podle italského vědce, udává počet strukturních jednotek v molě jakékoli látky, bez ohledu na její vnitřní strukturu, složení nebo původ.
Molární hmotnost
Hmotnost jednoho molu látky v chemii se nazývá "molární hmotnost", přičemž tato jednotka je vyjádřena poměrem g / mol. Při použití hodnoty molární hmotnosti v praxi lze vidět, že molární hmotnost vodíku je 2,02158 g / mol, kyslík - 1,0079 g / mol a tak dále.
Ad
Důsledky zákona Avogadro
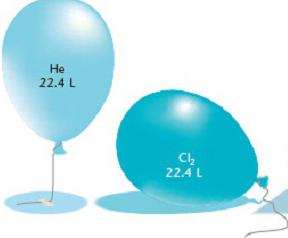
Avogadroův zákon je zcela použitelný pro stanovení množství látky při výpočtu objemu plynu. Stejný počet molekul jakékoliv plynné látky za stejných podmínek má stejný objem. Na druhou stranu obsahuje 1 mol jakékoliv látky nezměněný počet molekul. Závěr se naznačuje: při konstantní teplotě a tlaku zaujímá jeden mol plynné látky konstantní objem a obsahuje stejný počet molekul. Číslo Avogadro uvádí, že objem 1 mol plynu obsahuje 6,02 x 10 23 molekul.
Vypočítejte objem plynu za běžných podmínek
Normální podmínky v chemii - to je atmosférický tlak 760 mm Hg. Art. a při teplotě 0 ° C. S těmito parametry bylo experimentálně zjištěno, že hmotnost jednoho litru kyslíku je 1,43 kg. Proto je objem jednoho molu kyslíku 22,4 litrů. Při výpočtu objemu jakéhokoli plynu výsledky vykazovaly stejnou hodnotu. Takže Avogadrova konstanta učinila další závěr týkající se objemů různých plynných látek: za normálních podmínek jeden mol nějakého plynného prvku trvá 22,4 litrů. Tato konstantní hodnota se nazývá molární objem plynu.