Elektrochemická koroze a ochrana proti ní
Koroze se týká procesu spontánní destrukce povrchu materiálů v důsledku interakce s prostředím. Jeho příčinou je termodynamická nestabilita chemických prvků vůči určitým látkám. Formálně polymery, dřevo, keramika, kaučuk podléhají korozi, ale termín "stárnutí" je pro ně častěji aplikován. Nejzávažnější škody jsou způsobeny korozi kovů, pro které jsou vyvíjeny vysoce technické protiopatření. Ale o tom budeme hovořit později. Vědci se liší v chemické a elektrochemické korozi kovů.

Chemická koroze
Obvykle se vyskytuje při vystavení kovové struktuře suchých plynů, kapalin nebo roztoků, které nevedou elektrický proud. Podstatou tohoto typu koroze je přímá interakce kovu s agresivním prostředím. Prvky chemicky korodují během tepelného zpracování nebo v důsledku dlouhodobého provozu při dostatečně vysokých teplotách. To platí pro nože. plynové turbíny, tavicí pece tvarovek, části spalovacích motorů a tak dále. V důsledku toho se na povrchu vytvářejí určité sloučeniny: oxidy, nitridy, sulfidy.
Elektrochemická koroze
Je výsledkem kontaktu kovu s kapalným médiem, které je schopné provádět elektrický proud. V důsledku oxidace materiál prochází strukturálními změnami, což vede k tvorbě hrdze (nerozpustný produkt), nebo jsou částice kovu přeneseny do roztoku iontů.
Elektrochemická koroze: příklady
Je rozdělen na:
- Atmosféra, ke které dochází, když na povrchu kovu je kapalný film, v němž jsou plyny obsažené v atmosféře (například O 2 , CO 2 , SO 2 ) schopny rozpouštění při tvorbě elektrolytických systémů.
- Tekutina, která teče ve vodivém kapalném médiu.
- Půda, která teče pod vlivem podzemní vody.
Důvody
Vzhledem k tomu, že obvykle kov, který se používá pro průmyslové účely, není zcela čistý a obsahuje inkluze různých druhů, vzniká elektrochemická koroze kovů v důsledku tvorby velkého počtu zkratovaných lokálních galvanických článků na povrchu železa.
Jejich vzhled může být spojen nejen s přítomností různých (zejména kovových) nečistot (kontaktní koroze), ale také s povrchovou heterogenitou, vadami krystalová mřížka mechanické poškození a podobně.
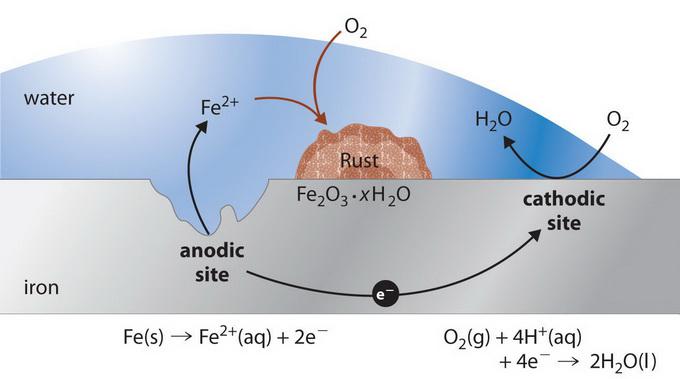
Interakční mechanismus
Proces elektrochemické koroze závisí na chemickém složení materiálů a environmentálních vlastnostech. Pokud je takzvaný technický kov pokryt mokrou vrstvou, pak v každém z těchto galvanických mikroelementů, které se tvoří na povrchu, se uskuteční dvě nezávislé reakce. Aktivnější složka korozívního páru dodává elektrony (například zinek v páru Zn-Fe) a vede do kapalného média jako hydratované ionty (tj. Koroduje) následující reakcí (anodický proces):
M + nH20 = Mz + * nH20 + ze.
Tato část povrchu je negativním pólem lokálního stopového prvku, kde se kov elektrochemicky rozpouští.
Na méně aktivní části povrchu, který je kladným pólem mikroelementu (železo ve dvojici Zn-Fe), jsou elektrony vázány redukcí (katodickým procesem) podle schématu:
Ox + ze = Červená.
Přítomnost oxidačních činidel ve vodní fólii, která jsou schopna vázat elektrony, tak umožňuje pokračovat v anodickém procesu. Elektrochemická koroze se proto může vyvinout pouze tehdy, pokud se objeví jak anodické, tak katodické procesy současně. V důsledku inhibice jedné z nich se rychlost oxidace snižuje.

Polarizační proces
Oba způsoby způsobují polarizaci odpovídajících pólů (elektrod) stopového prvku. Jaké jsou zde vlastnosti? Elektrochemická koroze kovů je zpravidla zpomalována polarizací katody. Proto bude amplifikován pod vlivem faktorů, které tuto reakci brání a jsou doprovázeny tzv. Depolarizací pozitivní elektrody.
V mnoha korozních procesech se katolická depolarizace provádí vypouštěním iontů vodíku nebo redukcí molekul vody a odpovídá vzorcům:
- V kyselém prostředí: 2H + + 2e = H 2 .
- V alkalickém roztoku : 2H20 + 2e = H2 + 2OH - .
Potenciální rozsah
Potenciál, který odpovídá těmto procesům v závislosti na povaze agresivního prostředí, se může měnit od -0,83 do 0 V. Pro neutrální vodný roztok při teplotách blízkých standardu je to přibližně -0,41 V. V důsledku toho ionty vodíku, obsažených ve vodě a v neutrálních vodných systémech, může oxidovat pouze kovy s potenciálem menším než -0,41 V (umístěné v sérii napětí kadmia). Vzhledem k tomu, že některé prvky jsou chráněny oxidovým filtrem, počet kovů náchylných k oxidaci v neutrálních médiích ionty vodíku je nevýznamný.
Pokud vlhký film obsahuje rozpuštěný kyslík vzduchu, je schopen v závislosti na povaze média vázat elektrony účinkem depolarizace kyslíku. V tomto případě je schéma elektrochemické koroze následující:
- O2 + 4e + 2H20 = 4OH - nebo
- O 2 + 4e + 4H + = 2H 2O.
Potenciály těchto reakcí elektrod při teplotách blízkých standardnímu rozmezí od 0,4 V (alkalické médium) do 1,23 V (kyselé prostředí). V neutrálním prostředí potenciál procesu snižování kyslíku za těchto podmínek odpovídá hodnotě 0,8 V. Proto je rozpuštěný kyslík schopen oxidovat kovy s potenciálem menším než 0,8 V (umístěné v sérii napětí na stříbro).

Hlavní oxidační činidla
Typy elektrochemické koroze jsou charakterizovány oxidačními prvky, z nichž nejdůležitější jsou ionty vodíku a kyslík. Současně je film obsahující rozpuštěný kyslík mnohem nebezpečnější, pokud jde o korozi než vlhkost, kde není kyslík, a který je schopen oxidovat kovy pouze ionty vodíku, protože v druhém případě je počet druhů materiálů, které mohou korodovat, mnohem menší.
Například u oceli a železa jsou uhlíkové nečistoty přítomny převážně ve formě karbidu železa Fe 3 C. V tomto případě je mechanismus elektrochemické koroze s depolarizací vodíku pro tyto kovy následující:
- (-) Fe - 2e + nH 2O = Fe 2+ · nH 2 O (může vznikat rzi);
- (+) 2H + + 2e = H2 (v okyseleném médiu);
- (+) 2H20 + 2e = H2 + 2OH - (v neutrálním a alkalickém prostředí).
Mechanismus korozi železa, který obsahuje nečistoty mědi, v případě kyslíkové depolarizace katody je popsán rovnicemi:
- (-) Fe-2e + nH 2O = Fe 2+ · nH 2O;
- (+) 0,5O2 + H20 + 2e = 2OH - (v okyseleném médiu);
- (+) 0,5O 2 + 2H + + 2e = H 2 O (v neutrálním a alkalickém prostředí).
Elektrochemická koroze probíhá různými rychlostmi. Tento indikátor závisí na:
- potenciální rozdíly mezi póly galvanického stopového prvku;
- složení a vlastnosti elektrolytického média (pH, přítomnost inhibitorů koroze a stimulantů);
- koncentrace (průtok) oxidačního činidla;
- teplotu
Metody ochrany
Elektrochemická ochrana kovů proti korozi se dosahuje těmito způsoby:
- Vytváření antikorozních slitin (legování).
- Zvyšte čistotu jednotlivých kovů.
- Nanášením na povrch různých ochranných povlaků.
Tyto povlaky jsou:
- Nekovové (barvy, laky, maziv smalt).
- Kovové (anodické a katodické povlaky).
- Tvorba speciální povrchové úpravy (pasivace železa v koncentrované kyselině sírové nebo síranu vápenatém) kyselina dusičná; železo, nikl, kobalt, hořčík v alkalických roztocích; tvorba oxidového filmu, například na hliníku).
Kovové plechy
Nejzajímavější a nejslibnější je elektrochemická ochrana proti korozi jiného druhu kovu. Podle povahy ochranného účinku jsou metalizované povlaky rozděleny na anodické a katodické. Pojďme se zabývat tímto bodem podrobněji.
Anodický povlak je povlak tvořený aktivnějším (méně ušlechtilým) kovem, než je ten, který je chráněn. To znamená, že ochrana je prováděna prvkem, který je v rozsahu napětí na základním materiálu (například zinkování nebo kadmiové pokovování železa). V případě místního zničení ochranné vrstvy korozní méně povlak z ušlechtilého kovu. V zóně škrábanců a prasklin se vytvoří lokální galvanický článek, jehož katodou je kov, který má být oplocen a anoda je povlak, který je oxidován. Integrita takového ochranného filmu nezáleží. Nicméně čím je silnější, tím pomalejší bude elektrochemická koroze, užitečný efekt bude trvat déle.
Katodická se nazývá povlak s vysokým potenciálem kovu, který v řadě napětí stojí po chráněném materiálu (například rozprašování nízkolegovaných ocelí mědí, cínu, niklu, stříbra). Povlak musí být spojitý, protože když je poškozen, vytvářejí se lokální galvanické články, jejichž základním kovem je anoda a ochrannou vrstvou je katoda.

Jak chránit kov před oxidací
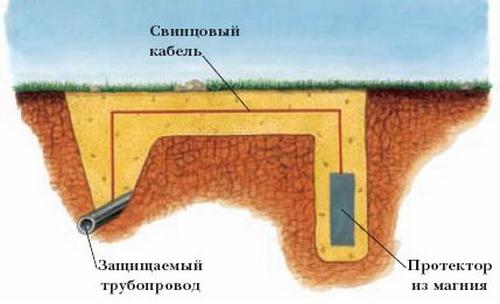
Elektrochemická ochrana proti korozi se dělí na dva typy: běhoun a katoda. Běhoun podobný anodové vrstvě. Větší deska aktivnější slitiny je připojena k materiálu, který má být chráněn. Vytvoří se galvanický článek, jehož základní kov slouží jako katoda a ochranou je anoda (koroduje). Obvykle se pro tento typ ochrany používají slitiny na bázi zinku, hliníku nebo hořčíku. Chránič se postupně rozpouští, takže je třeba ho pravidelně vyměňovat.
Mnoho potíží v odvětví veřejných služeb a v průmyslu jako celku je způsobeno elektrochemickou korozí potrubí. V boji proti ní je nejvhodnější metoda polarizace katody. K tomu je kovová struktura, která je chráněna před destruktivními oxidačními procesy, připojena k zápornému pólu nějakého zdroje vnějšího stejnosměrného proudu (pak se stává katodou, čímž se zvyšuje rychlost vývoje vodíku a koroze se snižuje) a kov s nízkou hodnotou je připojen k kladnému pólu .
Metody elektrochemické ochrany jsou účinné ve vodivém médiu (příkladem je mořská voda). Proto se chrániče často používají k ochraně podmořských částí lodí.
Agresivní manipulace
Tato metoda je účinná, když elektrochemická koroze železa probíhá v malém objemu vodivé kapaliny. Vypořádat se s ničivými procesy v tomto případě dvěma způsoby:
- Odstranění kyslíku z kapaliny (odvzdušnění) v důsledku vyplachování inertním plynem.
- Zavedení inhibitorů do životního prostředí - tzv. Inhibitory koroze. Například, pokud je povrch zničen oxidací kyslíkem, přidejte organické látky molekuly, které obsahují určité aminokyseliny (imino, thio a další skupiny). Jsou dobře adsorbovány na kovovém povrchu a významně snižují rychlost elektrochemických reakcí vedoucích k destrukci povrchové kontaktní vrstvy.
Závěr
Chemická a elektrochemická koroze samozřejmě způsobuje značné škody jak v průmyslu, tak v každodenním životě. Pokud kov nekorozí, životnost mnoha položek, částí, sestav, mechanismů by se výrazně zvýšila. Nyní vědci aktivně vyvíjejí alternativní materiály, které mohou nahradit kov, nikoliv špatně ve výkonu, ale je zřejmě nemožné úplně opustit jeho použití v krátkodobém horizontu. V tomto případě pokročily pokrokové způsoby ochrany kovových povrchů před korozí.