Gibbsova energie a její použití pro popis možnosti procesů
Koncept volné energie Gibbs byl zaveden do chemie, aby vysvětlil možnost spontánního nebo spontánního výskytu určité reakce. Výpočet této energie vyžaduje znalost změny entropie procesu a množství energie, která je absorbována nebo uvolněna během její implementace.
Josiah Willard Gibbs

Volná energie, která určuje možnost různých procesů, je označena velkým písmenem G. Jmenovala se Gibbsova energie na počest amerického teoretického fyziků z 19. století Josiah Willard Gibbs, který významně přispěl k rozvoji moderní teorie termodynamiky.
Je zajímavé poznamenat, že jeho první teze, po obhajobě toho, který Gibbs získal titul Ph.D., napsal o tvaru zubů ozubených kol. V této studii použil geometrické metody k vytvoření ideálního tvaru těchto zubů. Vědec začal studovat termodynamiku teprve ve věku 32 let a v této oblasti fyziky dosáhl velkého úspěchu.
Základní koncepty termodynamiky
Standardní energií Gibbs je energie za standardních podmínek, tj. Při pokojové teplotě (25 ° C) a atmosférickém tlaku (0,1 MPa).
Abychom porozuměli základním principům termodynamiky, měli bychom také představit koncepty entropie a entalpie systému.
Entalpií se rozumí vnitřní energie systému, který je při daném tlaku a objemu. Tato hodnota je označena latinkou H a je rovna U + PV, kde U - vnitřní energie systémy, P - tlak, objem systému V.
Entropie systému je fyzikální veličina, která charakterizuje míru poruchy. Jinými slovy, entropie popisuje umístění částic, které tvoří tento systém, to znamená, že charakterizuje pravděpodobnost existence každého stavu tohoto systému. Obvykle je označen latinkou S.
Proto je entalpie energetickou charakteristikou a entropie je geometrická. Všimněte si, že pro pochopení a popisování nastávajících termodynamických procesů absolutní hodnoty entropie a entalpie neposkytují užitečné informace, jsou důležité pouze jejich změny, to znamená ΔH a ΔS.
Termodynamické prohlášení
Tento zákon pomáhá pochopit, v jakém směru může reakce libovolně pokračovat, nebo bude v rovnováze. Následující tvrzení jsou základem termodynamiky:
- Druhý termodynamický zákon říká, že proces v libovolném systému se vyskytuje libovolně, jeho entropie se musí zvýšit, to jest ΔS> 0.
- Při konstantní teplotě a tlaku je změna Gibbsovy energie v systému určena vzorcem ΔG = ΔH - TΔS.
- Pokud pro nějaký proces ΔG <0, pak pokračuje spontánně a je nazýván exergonic.
- Směr libovolného průběhu určité reakce může záviset na teplotě v systému.
Spontánní procesy
V chemii jsou náhodné procesy ty, které se vyskytují bez vnějšího vstupu energie do nich. Tahle volnost naznačuje pravděpodobnost takové příležitosti a není v žádném případě spojena s kinetikou procesu. Takže může pokračovat rychle, to znamená, že má výbušný charakter, ale může pokračovat velmi pomalu po tisících a miliónech let.

Klasickým příkladem spontánně se vyskytující reakce je přeměna uhlíku ve formě diamantu na uhlíkovou alotropickou modifikaci grafitu. Taková reakce je tak pomalá, že během svého života si člověk nevšimne žádné změny v původním diamantu, a tak říkají, že diamanty jsou věčné, ačkoli pokud počkáte dostatečně dlouhou dobu, můžete vidět, jak se brilantní kámen stává černým, jako uhlíkový grafit.
Uvolňování a absorpce energie

Dalším důležitým aspektem arbitrárně probíhajících procesů je uvolňování nebo absorpce tepla, v prvním případě mluví o exotermickém procesu, v druhém případě o endotermický proces, to znamená, že je znamením změny entalpie ΔH. Mějte na paměti, že jak exotermní, tak endotermické procesy mohou probíhat libovolně.
Hlavním příkladem náhodného postupu je zapálení směsi paliva ve válci spalovacího motoru. Při této reakci se uvolňuje velké množství tepelné energie, která se přemění s účinností od asi 30% do mechanická energie čímž se klikový hřídel natáčí. Ta druhá přenáší točivý moment přes převod na kola vozidla a vůz se pohybuje.
Příkladem endotermické reakce, která probíhá nezávisle na absorpci tepla, je rozpuštění běžného chloridu sodného ve vodě. Při této reakci je ΔH = +3,87 kJ / mol> 0. Tuto skutečnost je možné zkontrolovat měřením teploty vody před rozpuštěním soli a poté, co se rozpustí. Výsledný rozdíl mezi konečnou teplotou a počáteční teplotou bude záporný.
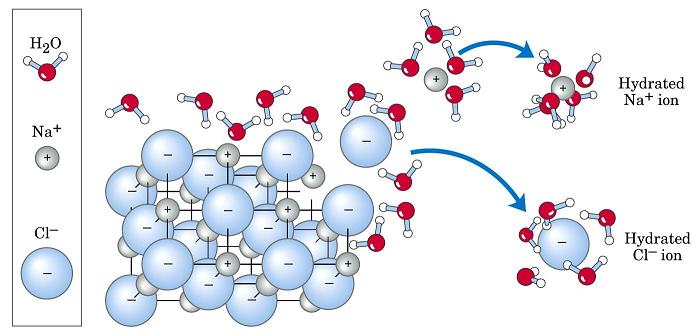
Gibbsův energetický proces
Pokud se nějaký proces uskutečňuje v systému s konstantním tlakem a teplotou, pak druhý zákon termodynamiky může být přepisován následovně: G = H - TS. Hodnota volné energie G - Gibbs má rozměr kJ / mol. Určení spontánnosti konkrétní reakce závisí na znamení změny v tomto množství, tj. ΔG. Výsledkem je, že druhý termodynamický zákon má formu: ΔG = ΔH -TΔS. Jsou možné následující případy:
- ΔG <0 - reakce se nazývá exergonic a náhodně se vyskytuje v dopředném směru s tvorbou produktů;
- ΔG> 0 - endergonická reakce, která se nemůže libovolně vyskytovat v dopředném směru, ale bude nezávisle procházet opačným směrem se zvýšením počtu činidel;
- ΔG = 0 - systém je v rovnováze a koncentrace reakčních složek a produktů zůstávají konstantní po delší dobu.
Analýza výsledné rovnice
Zavedený výraz pro druhý termodynamický zákon nám umožňuje určit, v jakém případě může proces postupovat libovolně. K tomu je třeba analyzovat tři veličiny: změnu entalpie ΔH, změnu entropie ΔS a teplotu T. Všimněte si, že teplota je vyjádřena v absolutních jednotkách podle mezinárodního systému váhy a měření, tj. U Kelvinů, proto je vždy kladná hodnota.
Směr reakce nezávisí na teplotě, pokud:
- Reakce je exotermická (ΔH <0) a její entropie se zvyšuje (ΔS> 0). V tomto případě proces probíhá libovolně v dopředném směru;
- Endotermická reakce (ΔH> 0) a změna její entropie jsou negativní (ΔS <0). Tento proces nikdy nebude spontánně směřovat dopředu.
Pokud se známky změn hodnot ΔH a ΔS shodují, teplota již hraje důležitou roli v možnosti takového procesu. Exotermická reakce tedy probíhá libovolně při nízkých teplotách a exotermická reakce při vysokých teplotách.
Výpočet tání ledu

Dobrým příkladem reakce, ve které závisí známka Gibbsovy energie od teploty, je tání ledů. Pro tento proces je ΔH = 6,01 kJ / mol, tj. Reakce je endotermická, ΔS = 22,0 J / mol * K, to znamená, že proces nastává se zvýšením entropie.
Pro tání ledů vypočítáme teplotu, při níž bude změna v Gibbsově energii nulová, to znamená, že systém bude v rovnovážném stavu. Z druhé termodynamické právo získáme: T = ΔH / ΔS, nahrazující hodnoty těchto veličin, vypočítáme T = 6,01 / 0,022 = 273,18 K.
Pokud převedeme teplotu z Kelvinů na obvyklé stupně Celsia, získáme 0 ° C. To znamená, že při teplotě vyšší než je hodnota ΔG <0 a spočívá v spontánním roztavení ledu při teplotě pod 0 ° C ΔG> 0 a reverzní proces se uskuteční libovolně, to znamená krystalizace kapalné vody.