První zákon termodynamiky pro průměrného člověka.
Celá lidská činnost je založena na spotřebě energie. Bez energie je obtížné si představit činnost organismu, fungování všeho pro lidi. Je důležité jak uvnitř člověka, tak pro jeho vnější existenci. Různé odvětví nemohou pracovat samy, protože potřebují energii. Přeprava zboží, vytápění prostorů, syntéza nových látek v buňkách těla - to vše je způsobeno schopností produkovat práci.
Místo energie v termodynamice
K určení místa energie v této oblasti vědy bychom měli zjistit, co přesně znamená termín "termodynamika". Jedná se o oblast fyziky, ve které jsou hlouběji studovány procesy přeměny energie. Každý ví, že energie je prezentována v několika formách: může to být chemická, elektrická, tepelná, mechanická a lehká. Tato odvětví vědy má dokonce své vlastní zákony a principy, například první zákon termodynamiky a některé další. Na tomto základě lze říci, že tato oblast znalostí by neexistovala, kdyby nebyly známy vlastnosti výše popsané fyzikální veličiny.
Jak se mění energie?

Mnoho lidí nerozumí skutečnosti přenosu energie z jednoho státu do druhého. Ale v každodenním životě tak často používáme přechodnou energii, kterou už nebereme v úvahu, odkud pochází. Například, když se denně dostaneme do auta, nemyslíme si, že v okamžiku jízdy se chemická energie dostane do elektrické energie. V elektromotoru se počáteční elektrická energie přemění na mechanickou energii a v parní turbíně se teplo přemění na mechanickou fyzikální veličinu. Ve všech těchto případech existují určité kvantitativní poměry různých forem energie. Během transformačních procesů však dochází k určitým kvantitativním ztrátám: spotřeba užitečné energie je vždy vyšší než její výroba. Tento jev lze snadno vysvětlit: transformace se nedá dělat bez tření, během něhož se část energie stává teplem a rozptýlí se ve vesmíru. Ukazuje se, že tato část již nemůže být použita jako užitečné množství. Každá konverze tedy není bezztrátová.
První zákon termodynamiky
Při studiu procesu přeměny energie objevili vědci dva základní zákony. Tento článek bude věnován prvnímu z nich. Tento termodynamický zákon říká: pro každou změnu - chemickou nebo fyzickou - množství energie zůstává konstantní. Jiným způsobem je také nazýván zákon o ochraně energie. Z této definice vyplývá, že energie se náhle neobjeví a prostě nezmizí. Pokud v průběhu jakékoliv činnosti jde do různých forem od jednoho k druhému, pak se jeho celkový počet nezmění. Jinými slovy, energie není vytvořena nebo zničena, což odráží první zákon termodynamiky. Definice v různých zdrojích se může lišit, ale podstata zůstává stejná.

Historie objevu tohoto zákona
Začíná zákon od poloviny XIX. Století. Německý lékař Mayer, pozorující změnu barvy lidské krve v tropech, přemýšlel o vztahu mezi takovými fyzickými pojmy jako je teplo a energie. Na druhou stranu slavný vědec Joule upozornil na vývoj Meiera, něco dodaného z jeho strany. Všechny údaje o tomto zákoně spojil další německý lékař, Helmholtz, když studoval fyzikální základny orgánů vnímání - lidského sluchu a zraku. Právě ten zákon formuloval tak, že to dnes svět ví.
Druhy výměny energie
Teplo, k němuž dochází při přenášení jednoho typu energie na jiný, ovlivňuje změnu vnitřní energie předmětu. Když se změní, objeví se opozice vůči práci vnějších sil ovlivňujících tento objekt. Vnitřní energie může být kinetická (to je pohyb atomů objektu), potenciál (je uložen v chemických vazbách mezi atomy), gravitační energie celého systému (tj. Účinek na objekt gravitační síly které se projevují uvnitř). Na základě těchto druhů vědci identifikovali určité typy výměny energie.
- První z nich je běžně chápáno jako předizolované systémy - neexistuje žádná výměna energie a další prvky určitého systému.
- Druhým typem jsou uzavřené systémy, které jsou charakterizovány nedostatkem výměny systémových prvků, ale do zanedbatelné míry se vyměňuje energie.
- Otevřené systémy (třetí typ výměny) se vyznačují výměnou a energií a jejich prvky.
Koncepce vnitřní energie v termodynamice
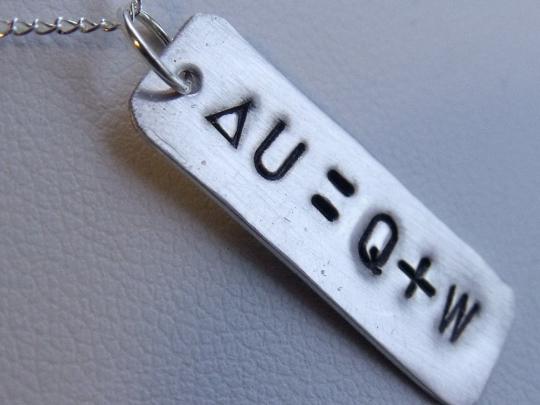
Vnitřní energie objektu nebo systému v termodynamice hraje téměř klíčovou roli. Ve skutečnosti je to složitá kombinace několika proudů molekul a atomů. Je složen z druhů, jako je energie rotačního a pohyb vpřed molekuly, energie pohybu atomů a skupin atomů, která se nachází uvnitř molekul a je emitována, když tyto částice oscilují. Jaderná energie atomů a interakční energie molekul mezi sebou souvisí také s vnitřní energií objektu. U NR závisí na počátečním stavu objektu a konečných indikátorech jeho stavu. Tato energie je kontinuální, jako první zákon termodynamiky. Lze jej snadno vypočítat podle následujícího vzorce: teplo přidané do systému, minus práce provedené tímto systémem. Nehovoříme zde o podstatě procesu změny vnitřní energie, ani o konečném stavu rovnováhy, protože to již určuje druhé termodynamické právo.
Vztah tepla a vnitřní energie
Tyto pojmy jsou velmi úzce spjaty. Předpokládá se, že teplo je součástí vnitřní energie systému. Rozumíme tomu, co je to teplo. Samotný subjekt nemá v obvyklém smyslu slovo. Lze říci, že teplo je energie, která prochází z objektu s vysokou teplotou na objekt s teplotou nižší než je teplota prvního objektu.

Jinými slovy, je součástí vnitřní energie objektu, který se z něj přenáší, protože má vyšší ukazatele teploty. Takový přenos ve fyzice a chemii se nazývá vytápění.
První zákon termodynamiky, chemie
Tento zákon má zásadní význam nejen pro fyzické experimenty, studium jevů a objev nových procesů, ale i pro další vědu - chemii - a její příbuzné odvětví. Když zkoumáme existenci a přenos energie do různých forem z hlediska chemických reakcí těla nebo objektu, otevře se horizont zajímavého výzkumu a vzorů v bioenergické rovině.

Mnoho lidí může mít pocit, že první zákon termodynamiky je vzdálený od života obyčejného člověka, že molekuly a atomy podléhají pochopení pouze malým počtem oddaných lidí. Ale to je daleko od případu. Základem života každého živého organismu je metabolismus, který nemůže nastat bez transformace energie. Proto jsou chemické procesy přeměny energie v lidském těle předmětem zvláštního zájmu nejen pro fyziky, ale i pro dietetiky a sportovní instruktory. Koneckonců, s vědomím všech vlastností tohoto procesu, můžete úspěšně pomoci lidem zbavit se extra kilo, stejně jako starat se o sebe s pomocí správně složeného menu se skládá ze zdravých potravin.