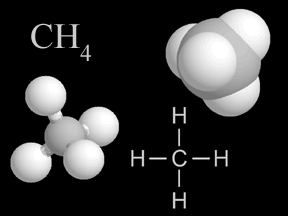
Alkanas: obecné informace. Fyzikální a chemické vlastnosti alkanů
Limitní uhlovodíky jsou takové sloučeniny, které jsou molekuly sestávající z atomů uhlíku ve stavu sp3 hybridizace. Jsou spojené výlučně kovalentními sigma vazbami. Název "okrajové" nebo "nasycené" uhlovodíky pochází ze skutečnosti, že tyto sloučeniny nemají schopnost připojovat žádné atomy. Jsou okrajové, zcela nasycené. Výjimkou jsou cykloalkany.
Co jsou alkány?
Alkany omezují uhlovodíky a jejich uhlíkový řetězec je neuzavřený a skládá se z atomů uhlíku propojených jednoduchými vazbami. Neobsahuje jiná (tj. Dvojnásobná, stejně jako alkenová nebo trojnásobná, jako u alkylu) vazby. Alkány jsou také nazývány parafiny. Obdrželi toto jméno, protože známé parafiny jsou směs převážně z těchto nasycených uhlovodíků C 18 -C 35 se zvláštní inertností.
Obecné informace o alkánech a jejich radikálů
Jejich vzorec: С n Р 2 n + 2 , zde n je větší nebo roven 1. Molární hmotnost vypočtená podle vzorce: M = 14n + 2. Charakteristická vlastnost: konce jejich jména jsou "-an". Zbytky jejich molekul, které vznikly v důsledku substituce atomů vodíku za jiné atomy, se nazývají alifatické radikály nebo alkylové skupiny. Označují se písmenem R. Obecný vzorec monovalentních alifatických radikálů: C n P 2 n +1 , zde n je větší než nebo rovno 1. Molární hmotnost alifatických radikálů se vypočítá podle vzorce: M = 14n + 1. Charakteristická vlastnost alifatických zbytků: konce v názvech " bahno. " Molekuly alkanů mají své vlastní strukturní rysy:
- vazba C-C je charakterizována délkou 0,154 nm;
- vazba C-H je charakterizována délkou 0,109 nm;
- úhel valence (úhel mezi vazbami uhlík-uhlík) je 109 stupňů a 28 minut.
Začněte homologní řadu alkanů: methanu, ethanu, propanu, butanu a tak dále.
Fyzikální vlastnosti alkanů
Alkány jsou látky, které jsou bezbarvé a nerozpustné ve vodě. Teplota, při které se alkany roztaví a teplota, při které se vaří, se zvyšuje v závislosti na zvýšení molekulové hmotnosti a délce uhlovodíkového řetězce. Z méně rozvětvených až větších větvených alkanů klesají teploty varu a tání. Plynné alkány jsou schopné hořet bledě modrým nebo bezbarvým plamenem, při kterém se vydává spousta tepla. CH4-C4H10 jsou plyny, které jsou také bez zápachu. C 5 H 12 -C 15 H 32 jsou kapaliny, které mají specifický zápach. C 15 H 32 a tak dále jsou pevné látky, které jsou také bez zápachu.
Chemické vlastnosti alkanů
Tyto sloučeniny jsou chemicky neaktivní, což lze vysvětlit silou tvrdých vazeb sigma - C - C a C - H. Je také třeba mít na zřeteli, že vazby C-C jsou nepolární a C-H jsou nízkopolární. Jedná se o nízko polarizovatelné typy vazeb souvisejících se sigmaformou, a proto jsou s největší pravděpodobností rozbité homolytickým mechanismem, v důsledku čehož se vytvoří radikály. Chemické vlastnosti alkanů jsou proto omezeny především na radikálové substituční reakce. 
Nitrační reakce
Alkany reagují pouze s kyselinou dusičnou o koncentraci 10% nebo s oxidem čtyřmocného dusíku v plynném prostředí při teplotě 140 ° C. Reakce nitrace alkanů se nazývá reakce Konovalova. V důsledku toho se tvoří nitrosloučeniny a voda: CH4 + kyselina dusičná (zředěný) = CH3-N02 (nitromethan) + voda.
Reakce na hoření
Limitní uhlovodíky se velmi často používají jako palivo, což je odůvodněno jejich schopností hořet: С n R 2n + 2 + ((3n + 1) / 2) O 2 = (n + 1) H 2 O + n CO 2 .
Oxidační reakce
Chemické vlastnosti alkanů zahrnují také jejich schopnost oxidovat. V závislosti na tom, jaké podmínky doprovázejí reakci a jak se mění, je možné získat různé konečné produkty z téže látky. Mírná oxidace methanu s kyslíkem v přítomnosti katalyzátoru, který zrychluje reakci, a teplota kolem 200 ° C může vést k následujícím látkám:
1) 2CH4 (oxidace kyslíkem) = 2CH3OH (alkohol - methanol).
2) CH 4 (oxidace s kyslíkem) = CH20 (aldehyd - methanol nebo formaldehyd) + H20.
3) 2CH4 (oxidace kyslíkem) = 2COOH (karboxylová kyselina - metan nebo mravenčí) + 2H20.

Také oxidace alkanů může být provedena v plynném nebo kapalném prostředí vzduchem. Takové reakce vedou k tvorbě vyšších mastných alkoholů a odpovídajících kyselin.
Postoj k teplu
Při teplotách nepřesahujících + 150-250 ° C, nutně v přítomnosti katalyzátoru, dochází k strukturální reorganizaci organických látek, která spočívá v změně pořadí atomových sloučenin. Tento proces se nazývá izomerizace a látky, které jsou výsledkem reakce, jsou izomery. Tak z normálního butanu získává jeho izomer - izobutan. Při teplotách 300 až 600 ° C a přítomnosti katalyzátoru se vazby C-H rozpadají na molekuly vodíku (dehydrogenační reakce), molekuly vodíku s uzavřením uhlíkového řetězce v cyklu (cyklizační reakce nebo aromatizace alkanů):
1) 2CH4 = C2H4 (ethen) + 2H2 .
2) 2CH4 = C2H2 (ethin) + 3H2 .
3) C7H16 (normální heptan) = C6H5-CH3 (toluen) + 4H2.
Halogenační reakce
Takové reakce spočívají v zavedení do molekuly organické látky halogeny (jejich atomy), což vede k vazbě C-halogenu. Když alkány interagují s halogeny, vytvářejí se halogenové deriváty. Tato reakce má specifické rysy. To protéká radikálním mechanismem a za účelem jeho zahájení je třeba jednat se směsí halogenů a alkanů s ultrafialovým zářením, nebo ji jednoduše ohřát. Vlastnosti alkanů umožňují, aby halogenační reakce probíhala až do úplné substituce atomy halogenů. To znamená, že chlorování methanu nebude končit v jednom stadiu a výroba methylchloridu. Reakce dále pokračuje, vytvoří se všechny možné substituční produkty, přičemž se vychází z chlormetanu a končí chloridem uhličitým. Vystavení chloru za těchto podmínek jiným alkanům bude mít za následek vznik různých produktů, které se získají v důsledku nahrazení vodíku různými atomy uhlíku. Poměr finálních produktů a rychlost jejich tvorby bude záviset na teplotě, při které probíhá reakce. Čím delší je alkanový uhlovodíkový řetězec, tím snadnější bude tato reakce. Během halogenace bude poprvé nahrazen atom uhlíku, který je nejméně hydrogenován (terciární). Primární bude reagovat po všech ostatních. Halogenační reakce se objeví ve stupních. V první fázi nahradit pouze jeden atom vodíku. C roztoků halogenů (chloru a bromu) alkany nereagují.
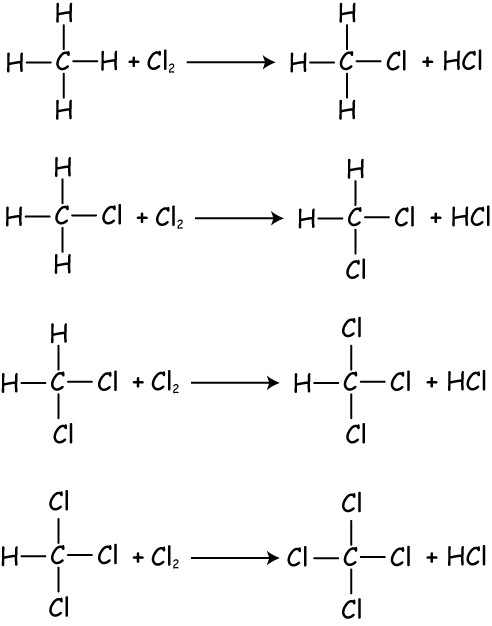
Sulfochlorační reakce
Chemické vlastnosti alkanů jsou také doplněny sulfochlorační reakcí (nazývá se Reedova reakce). Při expozici ultrafialové záření alkany jsou schopné reagovat se směsí chloru a oxidu siřičitého. Výsledkem je chlorovodík, stejně jako alkylový radikál, který se připojí k sobě oxid siřičitý. Výsledkem je složitá sloučenina, která se stává stabilní kvůli zachycení atomu chloru a zničení jeho další molekuly: R - H + SO 2 + Cl 2 + ultrafialové záření = R - SO 2 Cl + HCl. Sulfonylchloridy vzniklé v důsledku reakce se široce používají při výrobě povrchově aktivních látek.