Molekulová hmotnost: základní principy definice
Molekulární hmotnost je jedním ze základních pojmů moderní chemie. Jeho zavedení bylo umožněno po vědeckém zdůvodnění Avogadrova tvrzení, že mnoho látek sestává z drobných částic - molekul, z nichž každá se skládá z atomů. Věda vděčí tomuto úsudku italskému chemikovi Amadeo Avogadro, který je vědecky podložen molekulární struktura látky a chemie daly mnoho důležitých konceptů a zákonů.

Jednotky hmotnosti prvků
Původně byl atom vodíku považován za nejlehčí prvek ve vesmíru jako základní jednotku atomové a molekulové hmotnosti. Avšak většina atomových hmot byla vypočítána na základě jejich kyslíkových sloučenin, takže bylo rozhodnuto zvolit nový standard pro stanovení atomových hmotností. Předpokládala se, že atomová hmotnost kyslíku je 15, atomová hmotnost nejsvětlejší látky na Zemi, vodík, byla 1. V roce 1961 byl kyslíkový systém pro stanovení hmotnosti běžný, ale vytvořil určité nepříjemnosti.
V roce 1961 byla přijata nová měřítka. relativní atomové hmotnosti Jako referenční údaj byl uveden uhlíkový izotop 12C. Jednotka atomové hmotnosti (zkráceně Amu) je 1/12 hmotnosti této normy. V současné době je atomová hmotnost hmotností atomu, která by měla být vyjádřena v amu.
Hmotnost molekul
Hmotnost molekuly jakékoli látky se rovná součtu hmotností všech atomů tvořících danou molekulu. Nejlehčí molekulová hmotnost plynu je ve vodíku, jeho sloučenina je napsána jako H2 a má hodnotu blízkou dvěma. Molekula vody se skládá z atomu kyslíku a dvou atomů vodíku. To znamená, že jeho molekulová hmotnost je 15,994 + 2 * 1,0079 = 18,0152 amu. Největší molekulové hmotnosti mají složité organické sloučeniny - bílkoviny a aminokyseliny. Molekulová hmotnost struktury struktury proteinu je v rozmezí 600 až 106 a vyšší, v závislosti na počtu peptidových řetězců v této makromolekulární struktuře. 
Můra
Současně se standardními jednotkami hmotnosti a objemu se v chemii používá velmi zvláštní systémová jednotka, mole.
Molek je množství látky, která obsahuje tolik strukturních jednotek (ionty, atomy, molekuly, elektrony), tolik se nachází v 12 gramech izotopu 12 C.
Při použití míry množství látky je nutné uvést, které strukturní jednotky jsou míněny. Jak vyplývá z konceptu "krtek", měl by v každém jednotlivém případě přesně uvést, které strukturní jednotky se odkazují - např. Mol iontů H + , mol molekul H2 a tak dále.
Molární a molekulová hmotnost
Hmotnost látky v 1 molu se měří v g / mol a nazývá se molární hmotnost. Vztah mezi molekulární a molární hmotností může být napsán jako rovnice.
v = k × m / M, kde k je koeficient proporcionality.
Je snadné říci, že koeficient proporcionality se pro jakýkoli poměr bude rovnat jednomu. Izotop uhlíku má relativní molekulovou hmotnost 12 AU a molekulární hmotnost této látky je podle definice 12 g / mol. Poměr molekulové hmotnosti k molárnímu je 1. Proto můžeme usoudit, že molární a molekulová hmotnost mají stejné číselné hodnoty.
Objemy plynu
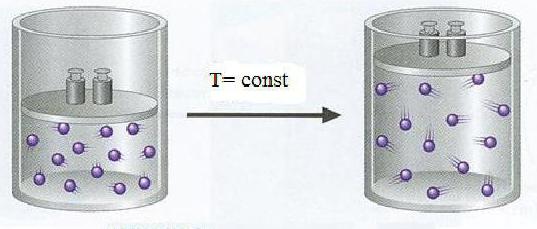
Jak víte, všechny látky kolem nás mohou být v pevném, kapalném nebo plynném agregačním stavu. U pevných látek je nejběžnějším základním měřítkem hmotnost, u pevných látek a kapalin, objem. To je způsobeno tím, že tuhé látky zachovávají svůj tvar a konečné rozměry. Kapalné a plynné látky nemají konečné rozměry. Charakterem jakéhokoli plynu je to, že vzdálenost mezi jeho strukturními jednotkami - molekulami, atomy, ionty - je mnohokrát větší než stejné vzdálenosti v kapalinách nebo pevných látkách. Například jeden mol vody za normálních podmínek zaujme objem 18 ml - přibližně stejné velikosti se vejde do jedné lžíce. Objem jednoho mol jemné krystalické soli je 58,5 ml a objem 1 mol cukru je 20krát více mol vody. Pro plyny je zapotřebí větší prostor. Jeden mól dusíku za normálních podmínek zabírá objem 1,240 krát více než jeden mol vody. 
Objemy plynných látek se tedy výrazně liší od objemu kapaliny a tuhého podílu. To je způsobeno rozdílem ve vzdálenostech mezi molekulami látek v různých stavech agregace.
Normální podmínky
Stav jakéhokoli plynu je vysoce závislá na teplotě a tlaku. Například dusík při teplotě 20 ° C zaujímá objem 24 litrů a při 100 ° C při stejném tlaku - 30,6 litru. Chemici vzali tuto závislost v úvahu, a proto bylo rozhodnuto snížit všechny operace a měření s plynnými látkami do normálních podmínek. Po celém světě jsou parametry normálních podmínek stejné. U plynných chemikálií jsou tyto:
- Teplota při 0 ° C
- Tlak 101,3 kPa.
Za normálních podmínek je akceptována zvláštní zkratka - n. Někdy tato notace není zapsána v úlohách, pak byste měli pečlivě přečíst podmínky problému a přenést dané parametry plynu do normálních podmínek.
Vypočítejte objem 1 mol plynu
Jako příklad lze snadno vypočítat jeden mol každého plynu, například dusík. K tomu musíte nejprve najít hodnotu relativní molekulové hmotnosti:
M r (N 2 ) = 2 x 14 = 28.
Vzhledem k tomu, že relativní molekulová hmotnost látky je číselně rovna molární, pak M (N 2 ) = 28 g / mol.
Experimentálně bylo zjištěno, že za normálních podmínek hustota dusíku je 1,25 g / litr.
Tuto hodnotu nahrazujeme standardním vzorcem známým z kurzu fyziky školy, kde:
- V je objem plynu;
- m je hmotnost plynu;
- ρ je hustota plynu.
Získáme molární objem dusíku za normálních podmínek
V (N2) = 25 g / mol: 1,25 g / l = 22,4 l / mol.
Ukazuje se, že jeden mol dusíku trvá 22,4 litru.
Pokud provádíte takovou operaci se všemi existujícími plynnými látkami, můžete přijít s překvapivým závěrem: objem plynu za běžných podmínek je 22,4 litru. Bez ohledu na to, který plyn je, jaká je jeho struktura a fyzikálně-chemické charakteristiky, jeden mol tohoto plynu obsadí objem 22,4 litru.

Molární objem plynu je jednou z nejdůležitějších konstant v chemii. Tato konstanta umožňuje vyřešit mnoho chemických problémů spojených s měřením vlastností plynů za běžných podmínek.
Výsledky
Molekulová hmotnost plynných látek je důležitá pro stanovení množství látky. A pokud vědce pozná množství látky v plynu, může určit hmotnost nebo objem takového plynu. Pro stejnou část plynné látky se současně splňují podmínky:
v = m / M V = V / V m.
Pokud odstraníme konstanta ν, můžeme vyrovnat tyto dva výrazy:
m / M = V / V m.
Takže můžete vypočítat hmotnost jedné části látky a její objem a také se stane známou molekulovou hmotností testované látky. Pomocí tohoto vzorce lze snadno vypočítat poměr objemu k hmotnosti. Při odlití tohoto vzorce do formy M = m Vm / V bude známa molární hmotnost požadované sloučeniny. Pro výpočet této hodnoty stačí znát hmotnost a objem zkušebního plynu.
Je třeba si uvědomit, že přísná korespondence skutečné molekulové hmotnosti látky s tou, která je ve vzorci nalezena, je nemožná. Každý plyn obsahuje hmotnost nečistot a přísad, které způsobují určité změny ve své struktuře a ovlivňují stanovení jeho hmotnosti. Ale tyto fluktuace provádějí změny ve třetí nebo čtvrté číslici za desetinnou čárkou ve výsledku. Proto jsou pro školní problémy a experimenty zjištěné výsledky hodnověrné.