Osmotický tlak v přírodě a lidském životě
Materiál poskytnutý k vašemu přehledu poskytne informace o osmotickém tlaku (g). Níže bude zváženo: formulace termínu, vlastností a vlastností, metody měření tlaku, vztah k biologii a vztah k řešením (pp) různých typů.
Znalost osmotického tlaku
Osmotický tlak je přebytek hydrostatického tlaku působícího na roztoky. Současně by samy roztoky měly být odděleny polopropustným typem membrány z čistých rozpouštědel. Proces rozpouštění difuze přes membránu v takových podmínkách nedochází. Účelem tohoto tlaku je usilovat o vytvoření rovnováhy mezi koncentracemi jakýchkoli roztoků a prostředkem je setkání molekulární difúze mezi rozpuštěnou látkou a rozpouštědlem. Osmotický tlak je označen písmenem "π" (pi).
O vlastnostech
Osmotický tlak má fenomén tonicity, což je gradientní míra osmotického tlaku. Jinými slovy, to je potenciál rozdílu vody ve dvojici p-ditch oddělených semipermeabilní membránou. Hypertonický roztok název látky má ve srovnání s jiným roztokem vyšší osmotický tlak. Hypotonický roztok, naopak, má nižší osmotický index.
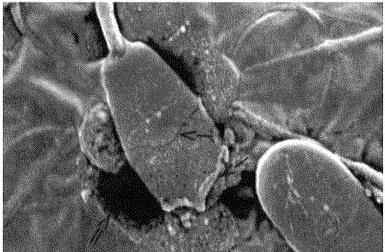
Pokud je takové řešení umístěno v uzavřeném prostoru, například v krevní buňce, uvidíme, že osmotický tlak se může buněčné membrány. Drogy zavedené do krve jsou nejprve smíchány s izotonickým p-rumem a přivádějí je k rozpuštění právě z tohoto důvodu. S tímhle chlorid sodný v roztoku by měla být obsažena v množství schopném vyvážit osmotický účinek buněčné tekutiny.
Pokud by léky podávaného typu byly vyrobeny na bázi vody nebo vysoce ředěných roztoků, osmotický rozklad by rozrušil krevní buňky tím, že přimělo k proniknutí vody do nich. Vytvoření roztoků s použitím příliš vysokých koncentrací látek přiměje vodu k opuštění buněk a v důsledku toho se zmenší. K tomu stačí ze tří až deseti procent chloridu sodného v p-re.
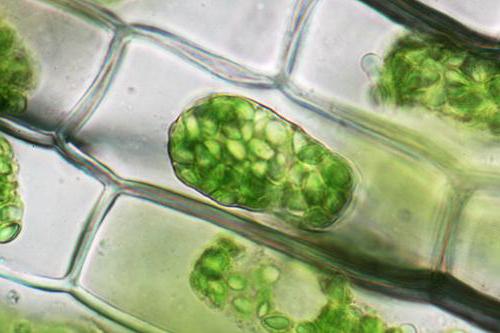
Rostlinné buňky, na rozdíl od zvířat, budou odděleny od buněčné stěny, veškerého jejího obsahu, s výjimkou vnější stěny buněk, ale společně s membránou. Tento jev se nazývá plasmolýza. Deplazmolizom je postup, který se pozoruje při pohybu srážení buněk v pp zředěného typu.
Vztah tlaku a roztoku
Chemická povaha rozpuštěných látek ve sloučenině nemá vliv na velikost osmotického účinku. Jeho rychlost závisí na množství těchto látek v p-re. Proto vidíme, že osmotický tlak je vlastností řešení. Tlak vzrůstá s rostoucí koncentrací účinných látek v p-re. To je naznačeno právem osmotického tlaku. Vzorec je poměrně jednoduchý:
π = i · C · R · T ,
kde izotonický koeficient je označen písmenem i , molární hladina koncentrace p-ra je vyjádřena C (mol / m3), univerzální plynový index jeho konstanty je označen písmenem R a T je termodynamická úroveň teploty p-ra.
Vzorec je podobný ideálnímu zákonu o plynu. Částice ve vzduchu perfektní plyn v rozpouštědlovém médiu viskózního typu, podobnosti jejich vlastností také ukazují jejich společné rysy. Toto prohlášení potvrzuje řadu experimentů prováděných J. B. Perrin v roce 1906. Pozoroval proces distribuce emulzních částic pryskyřice gummigovoy ve vodním sloupci, který obecně dodržoval zákon Boltzmann.
Existuje pojem onkotického osmotického tlaku, který závisí na množství bílkovin v roztoku. V důsledku hladovění nebo onemocnění ledvin se koncentrace bílkovin sníží. Z tohoto důvodu padne onkotický tlak a začnou se objevovat otoky onkotické povahy. Bude docházet k přenosu vody z tkání do plavidel, do těch míst, kde se nachází více Hnatelné procesy způsobují nárůst počtu osob dvakrát až třikrát. To je způsobeno ničením bílkovin, což vede ke zvýšení počtu částic.
Stabilní osmotický index by měl být přibližně 7,7 atm. Z tohoto důvodu izotonické roztoky typicky obsahují okolo π plazmy = 7,7 atm. Řešení s π přesahuje π plazmy , používá se k odstranění hnisu z ran nebo odstranění edému alergické povahy. Jsou také laxativními léky.
Termodynamický pohled na osmotický tlak
Vant-Hoffova formulace používaná pro osmotickou léčbu může být odvozena od termodynamického hlediska.

Volná energie, která je v roztoku, bude odpovídat G = G 0 + RTlnx A + π V C. Molární část roztoku bude označena x A , V C - to je indikátor molárního objemu. Termín π V C je ekvivalentní zavedení volné energie vnějšího tlaku. Čisté rozpouštědlo má G = G0 . Pokud rovnovážný index G rozpouštědla odpovídá indikátoru 0, dostaneme:
0 = ∇ G = G 0 + RTlnx A + π V C - G 0 = RT lnx A + π V C.
Výsledný záznam lze převést na vzorec van't Hoff.
O koloidních řešeních
Osmotický tlak roztoku může nastat, pokud jsou přítomny dvě podmínky:
- Je vyžadována semipermeabilní přepážka (membrána).
- Přítomnost dvou roztoků na obou stranách membrány, zatímco roztoky musí mít různé koncentrace.
Buněčná membrána může procházet částicemi specifických velikostí, například přiváděním a uvolněním molekuly vody, ale mají opačný účinek na C2H6O. Použitím speciálních materiálů, které mají takovou možnost oddělení, je možné oddělit různé složky směsi.
Osmotické roztoky se vypočítají použitím π = cRT. Tento vzorec byl odvozen společností Vant-Hoff v roce 1885 a Pfefferovy experimenty s porézním porcelánem sloužily jako základ pro jeho nalezení.
Turgor v kleci
Jak osmóza, tak osmóza jsou velmi důležitými složkami mnoha biologických systémů. Pokud struktura obsahuje semipermeabilní septum (specifická tkáň nebo buněčná stěna), pak konstantní rychlost osmózy vody vytvoří příliš velký hydrostatický tlak a v důsledku toho se vytvoří turgor, který zajistí pevnost a pružnost tkání.
Možná je fenomén hemolýzy, který je prasknutím buněčné membrány, jako je erytrocyt v důsledku nadměrného otoku, když je umístěn do čištěné vody.
Plasmolýza
Opačné procesy nastávají, když se buňka umístí do roztoků soli koncentrovaného typu: voda obsažená v buňce se bude difundovat do solných roztoků membránou. Výsledkem je, že buňka se zmenší a ztratí svůj turgor stabilního stavu. Tento jev se nazývá plasmolýza. Nicméně, turgor může být obnoven umístěním plazmolyzované buňky v protoplazmatické vodě. Objem buněk bude udržován pouze v isotonickém p-re se stejnou koncentrací (konstantní osmotický).
Shrnutí
Tento materiál umožnil čtenáři seznámit se s koncepcí osmotické léčby, formulovat obecnou představu o ní a naučit se mnoho zajímavých věcí. Například podobnost výpočtu vzorce s Van't Hoffovým vzorem, podobnost s ideálním plynem, role v biologických procesech a důsledky, které mohou způsobit, konkrétně turgor, plazmolýza, hemolýza a mnoho dalšího.