Oxidačním činidlem je atom akceptující elektrony.
Oxidační činidlo a redukční činidlo se používají k přípravě reakce v organické a anorganické chemii. Zvažte hlavní charakteristiky těchto interakcí, identifikujeme algoritmus pro kompilaci rovnice a uspořádání koeficientů.

Definice
Oxidační činidlo je atom nebo iont, který při interakci s jinými prvky přijímá elektrony. Proces tvorby elektronů se nazývá redukce a je spojen se snížením stupně oxidace.
V kurzu anorganická chemie Jsou zohledněny dvě hlavní metody nastavení koeficientu. Redukční činidlo a oxidační činidlo v reakcích se stanoví stanovením elektronové rovnováhy nebo metodou poloviční reakce. Budeme se zabývat první metodou umístění koeficientů v OVR.
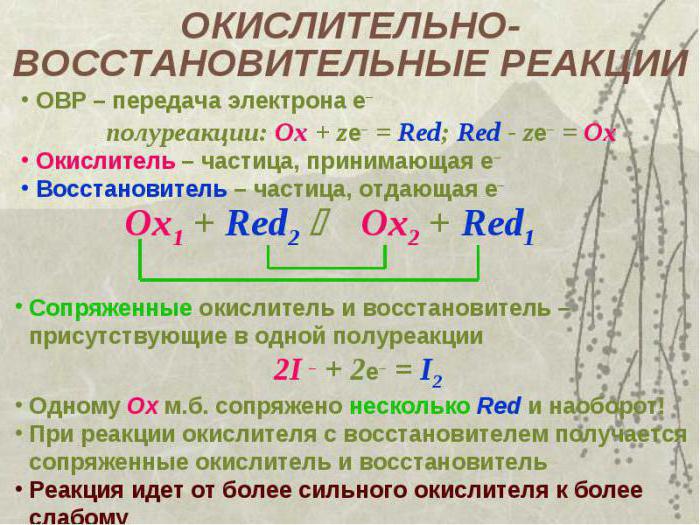
Oxidační stavy
Před stanovením oxidačního činidla v reakci je třeba umístit oxidačních stavů všechny prvky v látkách zapojených do transformace. Představuje náboj atomu prvku vypočítaného podle určitých pravidel. U komplexních látek by součet všech pozitivních a negativních stavů oxidace měl být nulový. U kovů hlavních podskupin odpovídá valence a má kladnou hodnotu.
U nekovů, které se nacházejí ve vzorci na konci, je stupeň určen odečtením čísla skupiny od osmi a má zápornou hodnotu.
Pro jednoduché látky se rovná nule, protože neexistuje proces přijímání nebo uvolňování elektronů.
Pro složité sloučeniny složené z několika chemických prvků se používají matematické výpočty ke stanovení stupňů oxidace.
Takže oxidační činidlo je atom, který v procesu interakce snižuje oxidační stav a redukční činidlo naopak zvyšuje jeho hodnotu.
Příklady iad
Hlavním rysem úloh souvisejících s distribucí koeficientů v redoxních reakcích je definice vynechaných látek a formulace jejich vzorců. Oxidační činidlo je prvek, který přijímá elektrony, ale kromě toho musí do reakce zapojit i redukční činidlo, které je dává pryč.
Dáváme generalizovaný algoritmus, pomocí kterého můžete provádět úkoly nabízené absolventům střední školy v jedné státní zkoušce. Zvažte několik konkrétních příkladů, abyste pochopili, že oxidační činidlo je nejen součástí komplexní látky, ale také jednoduché látky.
Nejprve je nutné stanovit hodnoty oxidačních stavů pro každý prvek pomocí určitých pravidel.
Dále je třeba analyzovat prvky, které se nepodílely na tvorbě látek, a vytvořit pro ně vzorec. Po odstranění všech mezer můžete pokračovat v procesu vytváření elektronické rovnováhy mezi oxidačním činidlem a redukčním činidlem. Výsledné koeficienty se v rovnici uvádějí, je-li to nutné, přidávají se k těm látkám, které nejsou zahrnuty do bilance.
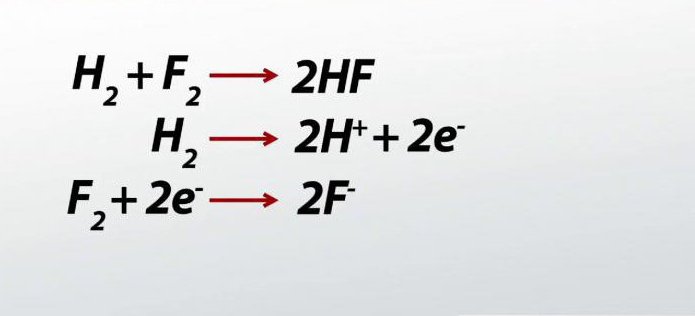
Například pomocí metody elektronické rovnováhy je nutné doplnit navrhovanou rovnici a před vzorky umístit potřebné koeficienty.
H 2 O 2 + H 2 SO 4 + KMnO 4 = MnSO 4 + O 2 + ... + ...
Za prvé, určíme hodnoty oxidačních stavů, které dostaneme
+K + Mn +7 O 4 -2 = Mn +2 S +6 O 4 -2 + O 2 0 + …+… H 2+ O 2 - + H 2+ S + 6 O 4 -2 + K + Mn + 7 O 4 -2 = Mn + 2 S + 6 O 4 -2 + O 2 0 + ... + ...
V navrhovaném schématu se liší v kyslíku a také v manganu v roce manganistan draselný. Redukční činidlo a oxidační činidlo se tedy nacházejí u nás. V pravé části neexistuje žádná látka, ve které by byl draslík, proto místo vynechání tvoříme vzorec jeho sulfátu.
Dále zapisujeme elektronickou rovnováhu. Kyslík bude v tomto případě vykazovat redukční vlastnosti, vzdát se dvou elektronů. Mangan je odvádí, vykazuje schopnost oxidovat.
Posledním krokem v tomto úkolu je nastavení koeficientů.
5H 2O 2 + 3H 2SO 4 + 2KMnO 4 = 2Mn SO 4 + 5O 2 + 8H 2O + K 2SO 4
Kyseliny, manganistan draselný, peroxid vodíku. Všechny kovy vykazují redukční vlastnosti, přeměňují se na reakce na kationty s kladným nábojem.
Závěr
Procesy týkající se přijímání a uvolňování negativních elektronů se vyskytují nejen v anorganické chemii. Metabolismus, který se provádí v živých organismech, je jasnou variantou průběhu redoxních reakcí v organické chemii. To potvrzuje význam uvažovaných procesů, jejich význam pro oživení a neživou povahu.