Jaká je distribuce elektronů v energetických hladinách různých chemických prvků?
Distribuce elektronů v energetických hladinách vysvětluje kovové i nekovové vlastnosti všech prvků.
Elektronický vzorec
Existuje jisté pravidlo, podle něhož jsou volné a spárované negativní částice umístěny na úrovních a podhledech. Podívejme se podrobněji na distribuci elektronů podle úrovní energie.
Na první energetické úrovni existují pouze dva elektrony. Orbity jsou naplněny jimi, jak se zvyšuje zásoba energie. Distribuce elektronů v atomu chemického prvku odpovídá pořadovému číslu. Na úrovni energie s minimálním počtem nejvýraznějších gravitace valenčních elektronů do jádra.
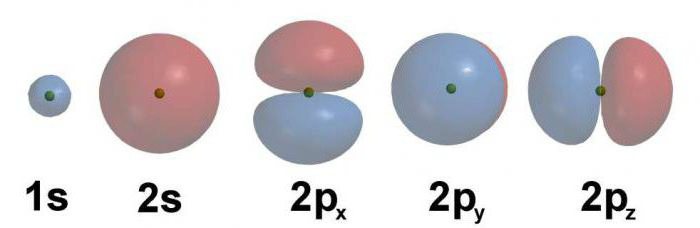
Příklad elektronického vzorce
Zvažte distribuci elektronů o energetických úrovní příkladem atomu uhlíku. Jeho pořadové číslo je 6, proto je uvnitř jádra umístěno šest protonů s kladným nábojem. Vzhledem k tomu, že uhlík je zástupcem druhého období, je charakterizován přítomností dvou energetických úrovní. Na prvním místě jsou dva elektrony, na druhém čtyři.
Pravidlo Hund vysvětluje uspořádání ve stejné buňce pouze dvou elektronů, které mají různé otáčky. Na druhé úrovni energie jsou čtyři elektrony. Výsledkem je distribuce elektronů v atomu chemického prvku v následující podobě: 1s22s22p2.
Existují jistá pravidla, podle kterých je distribuce elektronů pod úrovní a úrovní.
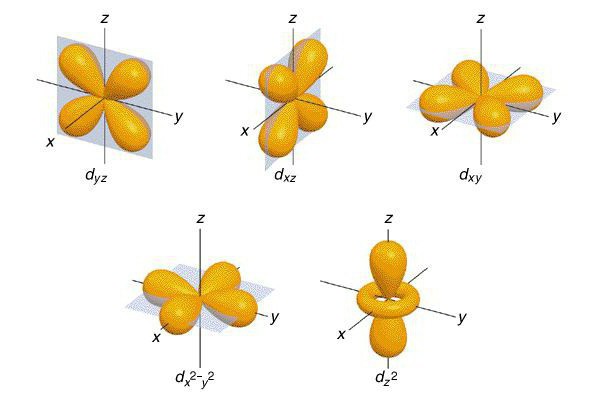
Pauliho princip
Tento princip byl formulován Pauli v roce 1925. Vědci se shodli na možnosti umístit do atomu pouze dva elektrony, které mají stejné kvantové číslo: n, l, m, s. Všimněte si, že distribuce elektronů v energetických hladinách nastává, když se zvyšuje zásoba volné energie.
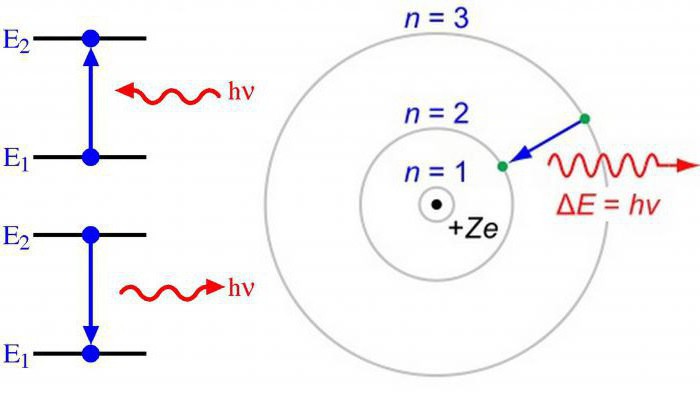
Pravidlo Klechkovského
Plnění energetických orbitálů se provádí podle nárůstu kvantových čísel n + l a je charakterizováno zvýšením energetické rezervy.
Zvažte distribuci elektronů v atomu vápníku.
V normálním stavu má elektronický vzorec následující formu:
Ca 1s2 2s2 2p6 3s2 3p6 3d0 4s2.
Prvky podobných podskupin souvisejících s d- a f-prvky, dochází k "selhání" elektronu z vnějšího podúrovního substrátu, který má menší rezervu energie, na předchozí d- nebo f-podúrovni. Podobný jev je charakteristický pro měď, stříbro, platinu, zlato.
Distribuce elektronů v atomu zahrnuje plnění podnárodních hladin nepárovými elektrony, které mají stejné rotace.
Teprve poté, co jsou všechny volné orbitály zcela naplněny jednotlivými elektrony, jsou kvantové buňky doplněny druhými negativními částicemi, které mají opačné točení.
Například v nezvyklém stavu dusíku:
1s2 2s2 2p3.
Vlastnosti látek mají účinek elektronická konfigurace valenčních elektronů. Podle jejich počtu můžete určit vyšší a nižší míru chemické aktivity. Pokud je prvek v hlavní podskupině periodické tabulky, je možné číslem skupiny provést vnější energetickou hladinu, určit ji oxidačních stavů. Například fosfor, který je v páté skupině (hlavní podskupina), obsahuje pět valenčních elektronů, proto je schopen přijmout tři elektrony nebo dát pět částic jinému atomu.
Výjimky z tohoto pravidla jsou všechny zástupce podskupin periodické tabulky.
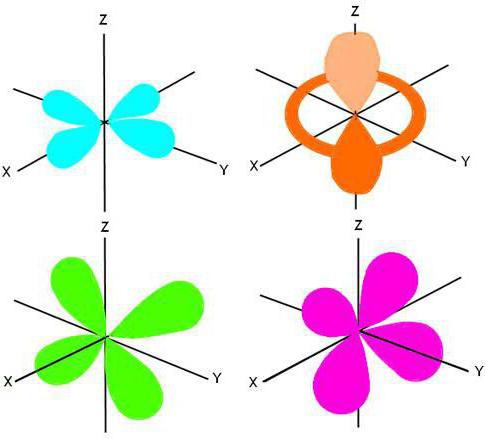
Rodinné funkce
V závislosti na struktuře vnější energetické úrovně je rozdělení všech neutrálních atomů v periodické tabulce na čtyři rodiny:
- s-prvky jsou v první a druhé skupině (hlavní podskupiny);
- p-rodina je lokalizována ve skupinách III-VIII (podskupiny A);
- d-elementy se nacházejí v podobných podskupinách ze skupiny I až VIII;
- F-rodina sestává z aktinidů a lanthanidů.
Všechny s-prvky v normálním stavu mají valenční elektrony na s-podúrovni. Přítomnost volných elektronů v s- a p-subblevels je charakteristická pro p-elementy.
D-elementy v nenaplneném stavu mají valenční elektrony jak na posledním s-tak na posledním, ale na jednom d-podúrovni.
Závěr
Stav jakéhokoli elektronu v atomu lze popsat pomocí sady základních čísel. V závislosti na charakteristikách jeho struktury můžeme mluvit o určitém množství energie. Použitím pravidla Hund, Klechkovského, Pauliho pro nějaký prvek obsažený v periodické tabulce můžete vytvořit neutrální konfiguraci atomů.
Elektrony nacházející se na prvních úrovních mají nejmenší množství energie v nevypracovaném stavu. Při zahřátí neutrálního atomu je pozorován přechod elektronů, který je vždy doprovázen změnou počtu volných elektronů, což vede k významné změně rychlosti oxidace prvku a ke změně jeho chemické aktivity.