Aromatické uhlovodíky: vše kolem nich
Chemie je velmi fascinující věda. Studie všech látek, které existují v přírodě, a mnoho z nich. Jsou rozděleny na anorganické a organické. V tomto článku se zabýváme aromatickými uhlovodíky, které patří do druhé skupiny.
Co to je?
To je organické látky které jsou složeny z jednoho nebo více benzenových jader - stabilních struktur šesti atomů uhlíku spojených v polygonu. Tyto chemické sloučeniny mají specifický zápach, který lze pochopit z jejich jména. Uhlovodíky této skupiny jsou cyklické, na rozdíl od alkanů, alkynů atd. 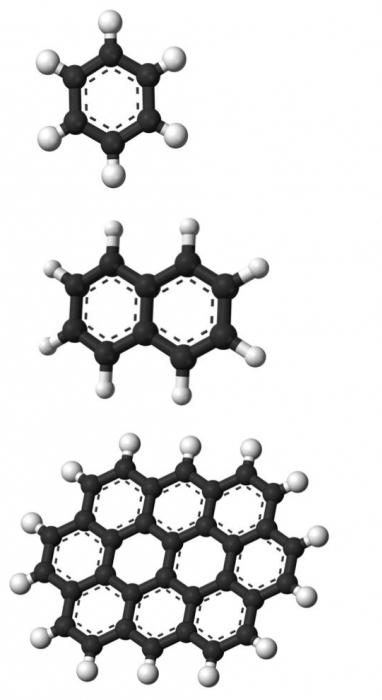
Aromatické uhlovodíky. Benzen
Jedná se o nejjednodušší chemickou sloučeninu z této skupiny látek. Složení jeho molekul sestává ze šesti atomů uhlíku a stejného množství vodíku. Všechny ostatní aromatické uhlovodíky jsou benzenové deriváty a mohou být získány s jeho použitím. Tato látka je za normálních podmínek v kapalném stavu, je bezbarvá, má specifický sladký zápach, nerozpouští se ve vodě. Vaření začíná při teplotě +80 stupňů Celsia a zmrazí se na +5.
Chemické vlastnosti benzenu a jiných aromatických uhlovodíků
První věcí, kterou hledáte, je halogenace a nitrace.
Substituční reakce
První je halogenace. V tomto případě je nutné pro chemickou interakci použít katalyzátor, totiž chlorid železitý. Pokud se tedy chlor (Cl 2 ) přidá k benzenu (C6H6), dostaneme chlorbenzen (C6H5Cl) a chlorovodík (HCl), který se uvolňuje jako čirý plyn se silným zápachem. To znamená, že v důsledku této reakce je jeden atom vodíku nahrazen atomem chloru. Totéž se může stát, když se do benzenu přidá další halogeny (jód, brom, atd.). Druhá substituční reakce - nitrace - následuje podobný princip. Zde koncentrovaný roztok působí jako katalyzátor. kyselina sírová. Pro tento druh chemická reakce je nutné přidat kyselinu dusičnou (HNO 3 ), koncentrovanou i na benzen, v důsledku čehož vznikne nitrobenzen (C6H5NO2) a voda. V tomto případě je atom vodíku nahrazen skupinou atomu dusíku a dvěma oxygenáty. 
Spojení reakcí
Jedná se o druhý typ chemických interakcí, do kterých mohou vstoupit aromatické uhlovodíky. Existují také ve dvou typech: halogenace a hydrogenace. První se vyskytuje pouze za přítomnosti sluneční energie, která působí jako katalyzátor. K provedení této reakce je třeba přidat chlor do benzenu, ale ve větších množstvích než v případě substituce. Jedna molekula benzenu by měla představovat tři chlóry. Výsledkem je získání hexachlorcyklohexanu (C6H6Cl6), tedy šest chlóru, které budou připojeny k existujícím atomům.
Hydrogenace probíhá pouze za přítomnosti niklu. Za tímto účelem míchat benzen a vodík (H2). Poměry jsou stejné jako v předchozí reakci. Výsledkem je cyklohexan (C6H12). Všechny tyto aromatické uhlovodíky mohou také vstoupit do tohoto typu reakce. Vyskytují se na stejném principu jako v případě benzenu, pouze při tvorbě složitějších látek.
Příjem chemikálií této skupiny
Začneme s benzenem stejně. Může se získat za použití činidla, jako je acetylen (C2H2). Ze tří molekul dané látky se pod vlivem vysoké teploty a katalyzátoru vytvoří jedna molekula požadované chemické sloučeniny.
Také benzen a některé další aromatické uhlovodíky lze extrahovat z černouhelného dehtu, který vzniká při výrobě hutního koksu. Toluen, o-xylen, m-xylen, fenanthren, naftalen, antracen, fluoren, chrysen, difenyl a další mohou být přičítány těm získaným tímto způsobem. Kromě toho jsou látky této skupiny často extrahovány z ropných produktů.
Jaké jsou různé chemické sloučeniny této třídy?
Styren je bezbarvá kapalina s příjemným zápachem, lehce rozpustná bod varu vody je +145 stupňů Celsia. Naftalen je krystalická látka, rovněž málo rozpustná ve vodě, taje při teplotě +80 stupňů a varu dosahuje +217. Za normálních podmínek je antracen také prezentován ve formě krystalů, avšak již bezbarvý, avšak žlutý. Tato látka není rozpustná ve vodě nebo v organických rozpouštědlech. Teplota tání - +216 ° C, varu - +342. Fenanthren vypadá jako lesklé krystaly, které se rozpouštějí pouze v organických rozpouštědlech. Teplota tání - +101 stupňů, varu - +340 stupňů. Fluoren, jak naznačuje název, je schopen fluorescence. To, stejně jako mnoho dalších látek této skupiny, jsou bezbarvé krystaly, nerozpustné ve vodě. Bod tání - +116, varu - +294. 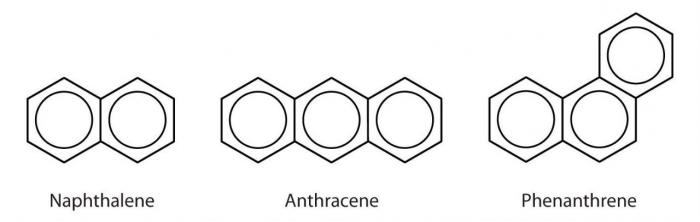
Použití aromatických uhlovodíků
Benzen se používá při výrobě barviv jako suroviny. Používá se také při přípravě výbušnin, pesticidů a některých léků. Styren se používá při výrobě polystyrenu (pěny) za použití polymerace původní látky. Ten je široce používán ve stavebnictví: jako tepelná a zvuková izolace, elektrický izolační materiál. Naftalen, jako benzen, se podílí na výrobě pesticidů, barviv a léků. Kromě toho se v chemickém průmyslu používá k výrobě mnoha organických sloučenin. Anthracen se také používá při výrobě barviv. Fluoren hraje roli stabilizátoru polymeru. Fenantren, stejně jako předchozí látka a mnoho dalších aromatických uhlovodíků, je jednou ze složek barviv. Toluen je široce používán v chemickém průmyslu pro extrakci organických látek, stejně jako pro výrobu výbušnin.

Charakterizace a použití látek vyrobených aromatickými uhlovodíky
Jedná se především o produkty zvážené chemické reakce benzenu. Chlorbenzen je například organické rozpouštědlo, používá se také při výrobě fenolu, pesticidů, organických látek. Nitrobenzen je součástí leštících činidel pro kovy, používá se při výrobě určitých barev a příchutí a může hrát roli rozpouštědla a oxidačního činidla. Hexachlorcyklohexan se používá jako jed pro potlačení hmyzích škůdců, stejně jako v chemickém průmyslu. Cyklohexan se používá při výrobě barev a laků při přípravě mnoha organických sloučenin ve farmaceutickém průmyslu.
Závěr
Po přečtení tohoto článku lze usoudit, že všechny aromatické uhlovodíky mají stejný typ chemické struktury, což umožňuje jejich kombinování do jedné třídy sloučenin. Kromě toho jsou jejich fyzikální a chemické vlastnosti také velmi podobné. Vzhled, teploty varu a teploty tání všech chemikálií této skupiny se neliší. Mnoho aromatických uhlovodíků se používá ve stejných odvětvích. Látky, které lze získat v důsledku halogenací, nitrací a hydrogenačních reakcí, mají také podobné vlastnosti a používají se pro podobné účely.