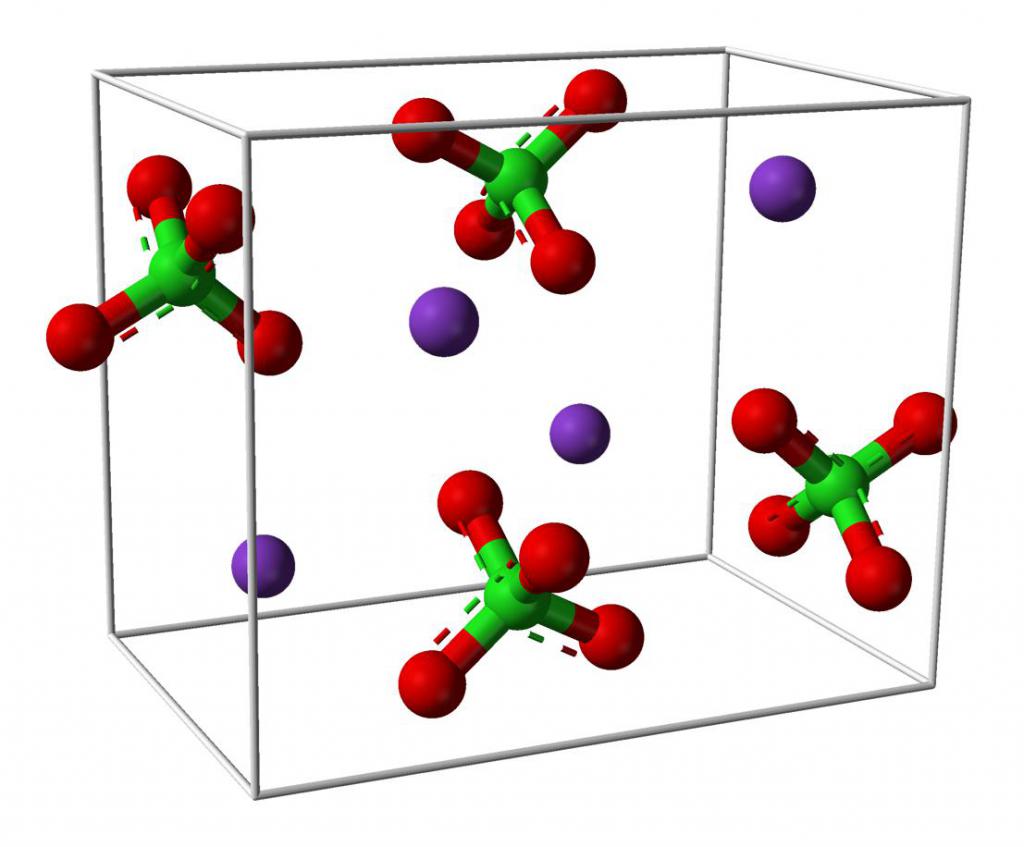
Chloristan sodný: vzorec, obecné informace, chemické vlastnosti
Chloristan sodný je bezbarvá krystalická látka bez zápachu. Je hygroskopický a tvoří několik krystalických hydrátů. Z chemického hlediska je sodná sůl kyseliny chloristé. Není hořlavý, ale má toxický účinek. Chemický vzorec chloristanu sodného je NaClO4.
Získání
Popsaná látka může být získána chemicky i elektrochemicky. V prvním případě se obvykle používá obvyklá výměnná reakce mezi kyselinou chloristou a hydroxidem nebo uhličitanem sodným. Tepelný rozklad chloranu sodného je také možný. Při 400 až 600 ° C vytváří chloristan a chlorid sodný. Ale tato metoda je poměrně nebezpečná, protože během reakce existuje hrozba výbuchu.
Teoreticky je možné provádět chemickou oxidaci chlorečnanu sodného. Nejúčinnějším oxidačním činidlem v tomto případě bude oxid olova v kyselém prostředí. Obvykle se k reakční směsi přidá kyselina chloristá.
Nejčastěji v průmyslu používají elektrochemickou metodu. Dává čistší produkt a obecně je efektivnější. Použitou surovinou je stejný chlorečnan sodný, který při oxidaci na anionu platiny vytváří chloristan. Aby byl proces hospodárnější, chlorát sodný se vyrábí na levnějších grafitových elektrodách. Existuje také slibná metoda pro výrobu chloristanu sodného v jednom stupni. Olověný peroxid se používá jako anoda.
Elektrochemické mechanismy
Mechanismus oxidace chlorečnanů na chloristan není ještě plně pochopen, existují pouze předpoklady o tom. Průzkum probíhá.
Nejvíce rozumná je varianta založená na předpokladu elektronového zpětného odrazu v anodě chlorečnanového iontu (ClO 3 - ), v důsledku čehož vzniká radikál ClO3. On, naopak, interaguje s vodou a vytváří chloristan.
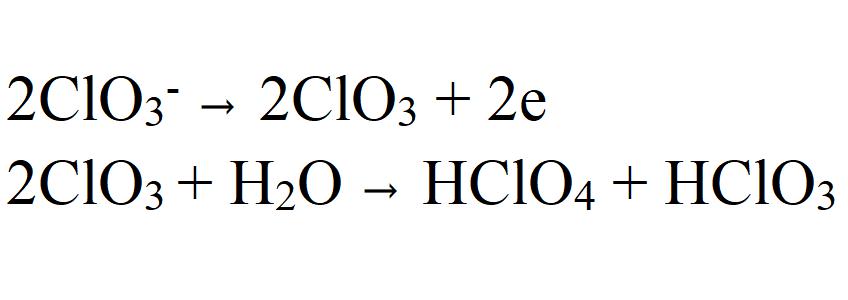
Tento předpoklad je vyjádřen v řadě uznávaných vědeckých prací. Potvrzuje to také výsledky studií oxidace chlorečnanů na chloristany ve vodných roztokech označených těžkými kyslíkovými izotopy 18 O. Bylo zjištěno, že 18 O je nejprve obsažen v chlorečnatém a teprve potom během oxidačního procesu se stává součástí chloristanu. Je však třeba mít na paměti, že změna anodového materiálu (například z platiny na grafit) může také změnit reakční mechanismus.
Druhou variantou procesu je oxidace chlorovaných iontů s kyslíkem, který vzniká, když se elektron uvolní hydroxidovým iontem.
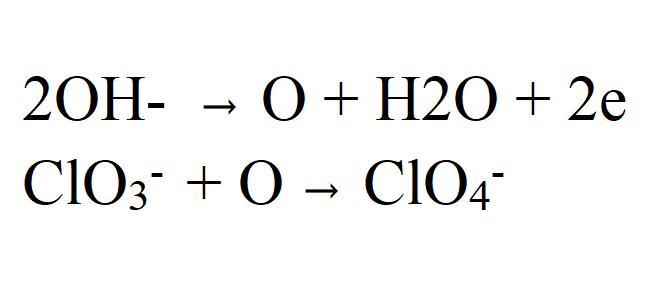
Podle tohoto variantu reakční rychlost přímo závisí na koncentraci chlorátu v elektrolytu, tj. S poklesem jeho koncentrace, rychlost by se měla zvýšit.
Existuje také možnost založená na současném uvolňování elektronů jak chloranem, tak i hydroxidovým iontem. Výsledné radikály jsou vysoce aktivní a jsou oxidovány kyslíkem, který je uvolňován z OH - .
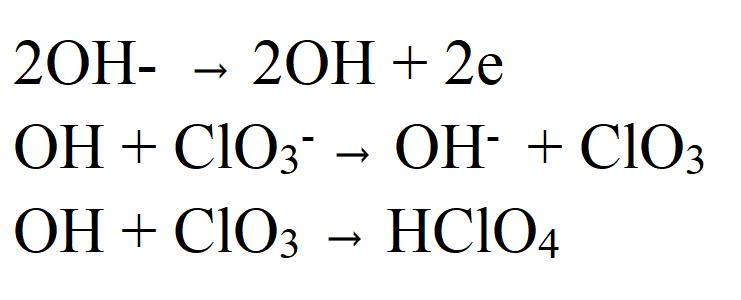
Fyzikální vlastnosti
Chloristan sodný je velmi rozpustný ve vodě. Jeho rozpustnost je mnohem silnější než u jiných chloristů. Z tohoto důvodu se při výrobě chloristanu nejdříve vyrobí chloristan sodný a v případě potřeby se převede do jiných solí kyseliny chloristé. Je také vysoce rozpustný v kapalném amoniaku, acetonu, peroxidu vodíku, ethanolu a ethylenglykolu.

Jak již bylo zmíněno výše, je hygroskopické a při hydrolyzování tvoří chloristan sodný krystalické hydráty (mono- a dihydráty). Může také tvořit solváty s jinými sloučeninami. Při teplotě 482 ° C se roztaví rozkladem na chlorid sodný a kyslík. Při použití aditiv peroxidu sodného, oxidu manganičitého, oxidu kobaltu (II, III) se teplota rozkladu snižuje na 150-200 ° C.
Chemické vlastnosti
Sodná sůl kyseliny chloristé je velmi silné oxidační činidlo, a to tak, že oxiduje mnoho organických látek na oxid uhličitý a vodu.
Chlornanový ion může být detekován reakcí s amonnými solemi. Při kalcinaci směsi probíhá reakce:
3 NaCl04 + 8NH4N03-> 3KCl + 4N2 + 8HNO3 + 12H2O.
Další metodou detekce je výměna reakce s draslíkem. Chloristan draselný je mnohem méně rozpustný ve vodě, takže se vysráží.
NaClO4 + KCI → KClO4 ↓ + NaCl.
S dalšími chloristany mohou vznikat komplexní sloučeniny: Na2 [Al (ClO4) 5 ], Na [Zn (ClO4) 3 ], Na [Cd2 (C104) 5 ].
Aplikace
Vzhledem k tvorbě krystalických hydrátů je použití chloristanu sodného velmi obtížné. V podstatě se používá jako herbicid, i když naposledy méně. Téměř veškerý chloristan sodný se přemění na jiné chloristany (například draslík nebo amonium) nebo kyselinu chloristou a používá se při syntéze mnoha dalších sloučenin kvůli silným oxidačním vlastnostem. Může být také použit v analytické chemii pro stanovení a srážení kationtů draslíku, rubidia a cesia, a to jak z vodných, tak z alkoholových roztoků.
Tepelný rozklad všech chloristů produkuje kyslík. Z tohoto důvodu může být sůl použita jako zdroj kyslíku v raketových motorech. Některé chloristany mohou být použity ve výbušninách. Chloristan draselný se používá v lékařství k léčbě hypertyreózy. Toto onemocnění je způsobeno zvýšenou funkcí štítné žlázy a jakýkoli chloristan má schopnost snížit aktivitu této žlázy, což je nezbytné k tomu, aby tělo bylo normální.
Nebezpečí
Samotný chloristan sodný je nehořlavý, ale při interakci s jinými látkami může způsobit požár nebo explozi. Při požáru může uvolňovat toxické plyny nebo výpary (chlor nebo chloridy). Kalení lze provést vodou.
Chloristan sodný se při pokojové teplotě prakticky nevypařuje, ale když je nastříkán, může vstoupit do těla. Při vdechování, kašli, podráždění sliznic dochází. Při kontaktu s pokožkou se objeví zarudnutí. Jako první pomoc se doporučuje místy umýt velkým množstvím vody a mýdlem a zbavit se kontaminovaného oblečení. Při dlouhodobém vystavení tělu vstoupí do krevního oběhu a vede ke vzniku methemoglobinu.
Když byla zvířatům (zejména hlodavcům) podávána 0,1 g chloristanu sodného, zvýšila se jejich reflexní excitabilita, křeče a tetanus. Po podání 0,22 g potkani zemřeli po 10 hodinách. Při zavedení stejné dávky holubů měli jen mírné příznaky otravy, ale po 18 hodinách zemřeli. To naznačuje, že podávání chloristanu sodného se vyvíjí velmi pomalu.