Chemická rovnováha a vytváření podmínek pro její posunutí
Studium parametrů systému včetně výchozích materiálů a reakčních produktů nám umožňuje zjistit, které faktory posouvají chemickou rovnováhu a vést k požadovaným změnám. Na základě zjištění Le Chatelier, Brown a dalších vědců o způsobech provádění reverzibilních reakcí jsou založeny průmyslové technologie, které umožňují provádět dříve zdánlivě nemožné procesy a získávat ekonomické výhody.
Rozmanitost chemických procesů
Podle zvláštností tepelného účinku se mnoho reakcí připisuje exo-nebo endotermickému. Prvním z nich je tvorba tepla, například oxidace uhlíku, hydratace koncentrované kyseliny sírové. Druhý typ změny je spojen s absorpcí tepelné energie. Příklady endotermických reakcí: rozpad uhličitan vápenatý se vzděláním hydrát vápna a oxid uhličitý tvorba vodíku a uhlíku při tepelném rozkladu methanu. V rovnicích exotermických a endotermických procesů je nutné uvést tepelný účinek. Redox distribuce elektronů mezi atomy reakčních látek se vyskytuje u redoxních reakcí. Čtyři typy chemických procesů se vyznačují vlastnostmi činidel a výrobků:
- sloučenina A + B = C;
- rozklad C = A + B;
- substituce AB + C = AC + B;
- výměna AB + SD = AC + VD.
Pro charakterizaci procesů je důležitá úplnost interakce reagujících sloučenin. Tato vlastnost je základem rozdělení reakcí na reverzibilní a nevratné.
Reverzibilita reakcí
Reverzibilní procesy tvoří většinu chemických jevů. Tvorba konečných produktů z činidel je přímá reakce. Naopak, původní látky jsou získány z produktů jejich rozkladu nebo syntézy. V reakční směsi dochází k chemické rovnováze, při které se získá tolik sloučenin, jak se rozkládají počáteční molekuly. Při reverzibilních postupech místo značky "=" mezi činidly a výrobky se používají symboly "↔" nebo "⇌". Šipky mohou být nerovné v délce, kvůli dominanci jedné z reakcí. V chemických rovnicích lze uvést souhrnné charakteristiky látek (d - plyny, g - kapaliny, t - pevné látky). Velmi praktický význam mají vědecky založené metody vlivu na reverzibilní procesy. Produkce amoniaku se tak stala zisková po vytvoření podmínek, které posunují rovnováhu směrem k tvorbě cílového produktu: 3H 2 (g) + N 2 (g) 2NH 3 (g) . Nevratné jevy vedou k vzhledu nerozpustné nebo špatně rozpustné sloučeniny, přičemž vzniká plyn opouštějící reakční kouli. Tyto procesy zahrnují iontovou výměnu, rozklad látek.
Chemická rovnováha a podmínky jejího posunu
Charakteristiky přímých a reverzních procesů jsou ovlivňovány několika faktory. Jedním z nich je čas. Koncentrace látky odebrané pro reakci postupně klesá a koncentrace konečné sloučeniny se zvyšuje. Reakce směru dopředu je pomalejší, zpětný proces získává rychlost. V určitém intervalu probíhají dva protichůdné procesy synchronně. Dochází k interakci mezi látkami, ale koncentrace se nemění. Důvodem je dynamická chemická rovnováha zavedená v systému. Jeho uchování nebo změna závisí na:
- teplotní podmínky;
- koncentrace sloučenin;
- tlak (pro plyny).
Chemická rovnovážná posunutí
V roce 1884 navrhl vynikající vědec z Francie, A. L. Le Chatelier, popis toho, jak získat systém ze stavu dynamické rovnováhy. Metoda je založena na principu vyrovnání působení vnějších faktorů. Le Chatelier si všiml, že v reakční směsi existují procesy, které kompenzují vliv cizích sil. Zásada formulovaná francouzským výzkumníkem uvádí, že změna podmínek ve stavu rovnováhy podporuje reakci, která oslabuje vnější účinek. Rovnovážný posun se řídí tímto pravidlem, je pozorován při kompozici, teplotních podmínkách a tlaku. Technologie založená na zjištěních vědců se používají v průmyslu. Mnoho chemických procesů, které byly považovány za prakticky neproveditelné, jsou prováděny díky metodám posunu rovnováhy.

Vliv koncentrace
Změna rovnováhy nastává, když jsou některé z komponent odstraněny z interakční zóny nebo jsou zaváděny další části látky. Odstranění produktů z reakční směsi obvykle způsobuje zvýšení rychlosti jejich tvorby, přidávání látek naopak vede k jejich preferenčnímu rozkladu. Při procesu esterifikace při dehydratačním použití kyselina sírová. Při zavedení do reakční koule vzroste výtěžek methylacetátu: CH3COOH + CH3OHOCH3COOCH3 + H20. Pokud přidáte kyslík, který reaguje s oxid siřičitý, Tato chemická rovnováha se posunuje k přímému reakci tvorby oxidu sírového. Kyslík se váže na molekuly SO 3 , jeho koncentrace se snižuje, což je v souladu s pravidly společnosti Le Chatelier pro reverzibilní procesy.
Změna teploty
Procesy s absorpcí nebo tvorbou tepla jsou endo- a exotermické. K posunutí rovnováhy se používá teplo nebo teplo z reakční směsi. Zvýšení teploty je doprovázeno zvýšením rychlosti endotermických jevů, při kterých je absorbována dodatečná energie. Chlazení vede k exotermním procesům s uvolněním tepla. Když oxid uhličitý interaguje s uhlím, zahřívání je doprovázeno zvýšením koncentrace oxidu uhelnatého a chlazení vede k převládajícímu vzniku sazí: CO 2 (g) + C (t) 2CO (g) .
Tlakový efekt
Změna tlaku je důležitým faktorem pro reakci směsí, které zahrnují plynné sloučeniny. Měli byste také dávat pozor na rozdíl v objemech původních a výsledných látek. Snížení tlaku vede k převládajícímu průběhu jevů, při nichž se zvyšuje celkový objem všech složek. Zvýšení tlaku směřuje proces ke snížení objemu celého systému. Tento vzorec je pozorován při reakci tvorby amoniaku: 0,5N 2 (g) + 1,5H 2 (g) ⇌ NH 3 (g) . Změna tlaku neovlivní chemickou rovnováhu v těch reakcích, které se vyskytují při konstantním objemu.

Optimální podmínky pro realizaci chemického procesu
Vytvoření podmínek pro posun rovnováhy velmi určuje vývoj moderních chemických technologií. Praktické využití vědecké teorie přispívá k získání optimálních výsledků výroby. Nejvýraznějším příkladem je výroba amoniaku: 0,5N 2 (g) + 1,5H 2 (g) ⇌ NH 3 (g) . Zvýšení obsahu molekul N2 a H2 v systému je příznivé pro syntézu komplexní látky od jednoduchých. Reakce je doprovázena uvolněním tepla, takže snížení teploty způsobí zvýšení koncentrace NH3. Objem počátečních komponent je větší než cílový produkt. Zvýšení tlaku zvýší výtěžnost NH3.
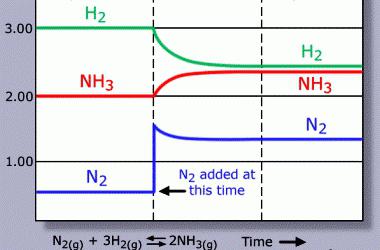
Ve výrobních podmínkách je zvolen optimální poměr všech parametrů (teplota, koncentrace, tlak). Kromě toho je důležitá oblast kontaktu mezi činidly. V pevném heterogenním systému vede zvýšení plochy k nárůstu reakční rychlosti. Katalyzátory zvyšují rychlost přímých a reverzních reakcí. Použití látek s takovými vlastnostmi nevylučuje chemickou rovnováhu, ale zrychluje její nástup.

