Vlastnosti struktury atomu vodíku
Nejběžnějším prvkem ve vesmíru, který se skládá z nejlehčích atomů, je vodík. To bylo objeveno ve 14. století velkým alchymistou Paracelsus. Vědci jsou oprávněně považováni za zakladatele nejen medicíny, ale také chemie. Struktura atomu vodíku byla důkladně přezkoumána Nielsem Bohrem. Prvek pak objevili astronomové jako součást Slunce a dalších planet, stejně jako v mlhovinách plynových hvězd. Proces přeměny atomů vodíku na atomy helia se vyskytuje v nich, jinými slovy, pozoruje se jaderná reakce. V našem článku budeme studovat nejen strukturu atomu vodíku, ale také zvážit charakteristické rysy vlastností tohoto chemického prvku.
Místo prvku v periodickém systému
Vodík je jediný chemický prvek, který je ve dvou skupinách periodického systému najednou: 1 a 7. Následující skutečnost lze vysvětlit: vykazuje dvojí chemické vlastnosti. Zvláštní struktura atomu vodíku dovoluje darovat svůj jediný elektron atomům, například aktivním prvkům - nekovům. Jedná se především o halogeny: agresivní ve svých vlastnostech fluor, chlor, brom a jod. H 2 snadno reaguje s chalcogeny: síra, kyslík, selén. V tomto případě se atomy vodíku převádějí na kationty - kladně nabité částice.
Díky této funkci se prvek stává v první skupině periodického systému. Mechanismus reakce mezi kovy a vodíkem vypadá jinak. Podle teorie struktury atomu vodíku podle N. Bohra má prvek jeden nepárový elektron. Atom H přijímá elektrony z aktivních atomů alkalických kovů nebo kovů alkalických zemin. Jeho elektronová konfigurace se tak stává podobná částice inertního plynu hélia. Jediná energetická vrstva je nyní dokončena. V těchto procesech se struktura atomu vodíku mění a mění se na formu aniontů. Z tohoto důvodu je prvek současně umístěn v periodické tabulce také ve své 7. skupině.

Všichni ve srovnání
Pokračujeme v studiu strukturních vlastností vodíkových částic, uvidíme, jak jejich vnitřní struktura ovlivňuje chování prvku v reakcích. K tomu je třeba věnovat pozornost nejbližším sousedům v periodickém systému a určit, jaká je struktura atomů vodíku, helia a lithia. S částicemi inertního plynu spojuje vodík stejné množství energie s lithiem, podobnou strukturu vnější energetické vrstvy, na které je umístěn jeden elektron. Vlastnosti vodíku jsou však velmi odlišné od inertního plynu i alkalického kovu. Tato skutečnost dokazuje, že všechny vlastnosti chemického prvku jsou určeny dutinovou strukturou atomu a molekuly vodíku, to jest počet energetických hladin a distribuce elektronů na nich.
Přivést k vodě
Název prvku naznačuje, že kombinace jeho atomů s částicemi kyslíku vede k vzniku takové jedinečné a důležité látky pro Zemi, jako je voda. Za normálních podmínek se tato reakce nevyskytuje, teplota spalování plynné směsi dosahuje 2800 ° C. V laboratoři vede interakce mezi H2 a O2 v poměru 2: 1 k výbuchu. Samotná směs se nazývá detonační plyn a proces probíhající v něm pokračuje mechanismem radikálů. Pokud není kontrolováno, reakce končí závažným problémem - silným výbuchem. Z tohoto důvodu, navzdory mimořádné lehkosti, byl vodík opuštěn jako plnidlo pro palubní letadla. Smutnou příčinou byla havárie letecké lodi Hindenburg pro Ameriku v roce 1937. Nyní uvidíme, jak struktura atomu vodíku ovlivňuje fyzikální vlastnosti plynu.

Vodík, deuterium, tritium
Nenechte se překvapit na výše uvedeném seznamu podmínek. Je to všechno o stejném chemickém prvku vodík, jaderný náboj atomu je +1. Druhá a třetí jména jsou jména izotopů. Důvod rozdílu spočívá v počtu neutronů v jádře, zatímco protonové číslo všech tří typů částic je stejné. Deuterium má dva neutrony, tritium má 3 a vodík sám má v jádru 1 neutron. Voda obsahující deuterium ve svých molekulách se nazývá těžká. Může se nalézt v chladicích nádržích jaderných elektráren, stejně jako v cytoplazmě buněk, které mají zhoršený normální metabolismus.
Elektronická struktura atomu vodíku
Níže uvedená schéma nám pomůže pochopit specifické chování jednoduché látky H2 v různých chemických interakcích.
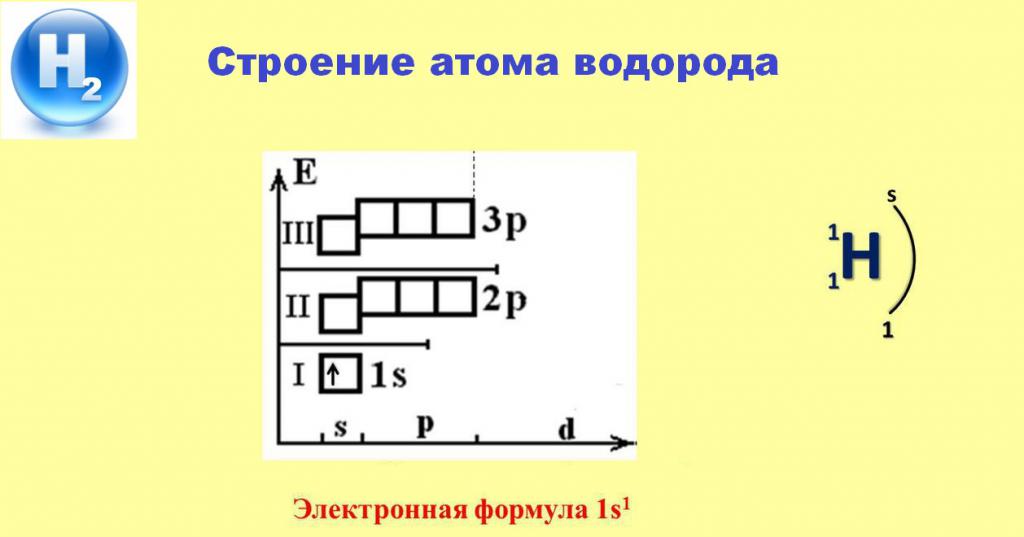
Přítomnost jednoho elektronu zabírajícího s-orbitální první energetickou hladinu zajišťuje konstantní valence vodíku rovnající se 1. Ve většině případů tento elektron opouští prostor atomu a přebírá více elektro-negativních prvků. Pouze reakce s kovy dovolují vodík odvádět elektron z atomů aktivních alkalických nebo alkalických zemin do sféry vlivu vlastního jádra, čímž vzniknou bílé krystalické sloučeniny - jejich hydridy.
Aktivní a agresivní
Atomový vodík, abych tak řekl, se snadno zvedá. Jiné redukční činidla, jako je uhlík nebo jeho oxidy, mohou závidět svou rychlost redukcí kovů z jejich oxidů. H atomy jsou také aktivně kombinovány s částicemi síry, kyslíku a fosforu. Plamenný hořák s atomovým vodíkem způsobuje oteplování nad 4000 ° C. Z těchto důvodů se taková zařízení snadno zpracovávají kovovými povrchy: řezáním nebo svařováním.

Atomový vodík je dobře zaveden jako redukční činidlo z čistých kovů - wolfram, molybden - ze svých rud, představovaných převážně oxidy. Když se setkáváme se stejnými atomy jako on sám, vodík vytváří stabilní a pasivní strukturu - molekulu. Oba atomy H se vzájemně drží pomocí společného elektronového páru, což je model stabilní kovalentní nepolární vazby. Je odolný a zajišťuje stabilitu molekul H 2 v podmínkách země i v prostoru. Potravinářský průmysl, ve kterém se používá v oblasti hydrogenace olejů a výroby nízkokalorických nástřiků, které jsou v moderním dietetickém průmyslu módní, nebyl bez vodíku.

V našem článku jsme zkoumali strukturu atomu vodíku a zjistili, jak ovlivňuje vlastnosti jednoduché látky.