Fyzikální a chemické vlastnosti uhlíku
Organický život na Zemi představují sloučeniny uhlíku. Prvek je součástí hlavních složek buněčných struktur: bílkoviny, sacharidy a tuky a také tvoří podstatu látky dědičnosti - deoxyribonukleové kyseliny. V anorganické povaze uhlíku je jedním z nejběžnějších prvků, které tvoří kůru a atmosféru planety. Organická chemie jako součást chemické vědy je zcela věnována vlastnostem uhlíku chemických prvků a jeho sloučenin. Náš článek zváží fyzikálně-chemické vlastnosti uhlíku a vlastnosti jeho vlastností.
Místo prvku v periodickém systému
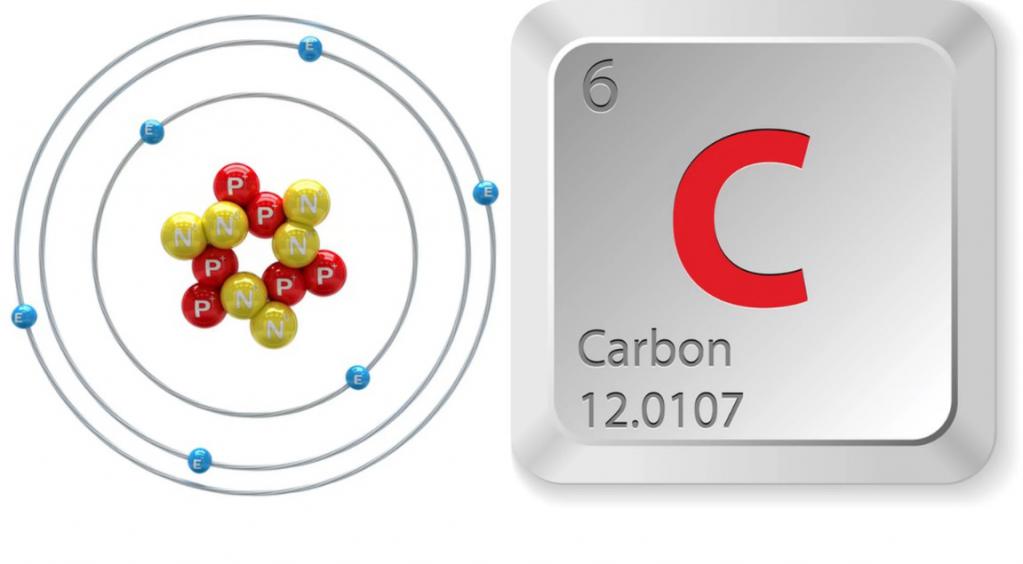
Podskupina uhlíku je hlavní podskupinou skupiny IV, která kromě uhlíku obsahuje také křemík, germanium, cín a olovo. Všechny uvedené prvky mají stejnou strukturu vnější energetické úrovně, na které jsou umístěny čtyři elektrony. To způsobuje podobnost jejich chemických vlastností. V obvyklém stavu jsou prvky podskupiny bivalentní a když jsou jejich atomy vzrušeny, vykazují valence rovnou 4. Fyzikální a chemické vlastnosti uhlíku závisí na stavu elektronických obalů jeho atomu. Při reakci s kyslíkem tedy prvek, jehož částice jsou v nenaplněném stavu, tvoří indiferentní oxid CO. Atomové atomy uhlíku v excitovaném stavu jsou oxidovány na oxid uhličitý, který vykazuje kyselé vlastnosti.

Uhlík tvoří v přírodě
Diamant, grafit a karbin jsou tři alotropické modifikace uhlíku jako jednoduché látky. Transparentní krystaly s vysokým stupněm lomu světelných paprsků, které jsou v přírodě nejtvrdšími sloučeninami, jsou diamanty. Vedou špatně teplo a jsou dielektrikum. Křišťálová mřížka je atomová, velmi trvanlivá. V něm je každý atom prvku obklopen čtyřmi dalšími částicemi, tvořícími pravidelný čtverec.
Úplně odlišné fyzikálně-chemické vlastnosti uhlíku, který tvoří grafit. Je to mastná, tmavě šedá krystalická látka. Má vrstvenou strukturu, vzdálenosti mezi vrstvami atomů jsou poměrně velké, zatímco jejich přitažlivé síly jsou slabé. Proto se při stlačení grafitové tyče rozdělí látka do tenkých stupnic. Zanechávají na papíře tmavou značku. Grafit je vodivý a poněkud horší než kovy v elektrické vodivosti.
Schopnost provádět elektrický proud je vysvětlena strukturou krystalické látky. V tom jsou uhlíkové částice navázány na ostatní tři silnými kovalentními chemickými vazbami. Čtvrtý valenční elektron každého atomu zůstává volný a je schopen se pohybovat v tloušťce látky. Směrový pohyb negativně nabitých částic a způsobuje vzhled elektrického proudu. Grafitové aplikace jsou různé. Používá se proto k výrobě elektrod v elektrotechnice a k provádění elektrolýzy, pomocí něhož se získávají například alkalické kovy v čisté formě. Grafit nalezl aplikaci v jaderných reaktorů k řízení rychlosti řetězových reakcí probíhajících v nich jako moderátor neutronů. Je známo, že látka je používána jako břidlicová tyč nebo maziva v třecích částech mechanismů.
Co je karbin?
Černý krystalický prášek se sklovitým leskem je karban. To bylo syntetizováno v polovině 20. století v Rusku. Látka má vynikající tvrdost vůči grafitu, chemicky pasivní, má vlastnosti polovodičů a je nejstabilnější modifikací uhlíku. Sloučenina je odolnější než grafit. Existují také formy uhlíku, jejichž chemické vlastnosti se navzájem liší. Jedná se o saze, uhlí a koks.
Různé vlastnosti uhlíkových alotropních modifikací jsou vysvětleny strukturou jejich krystalových mřížek. Je to žáruvzdorná látka bez barvy nebo zápachu. Je nerozpustný v organických rozpouštědlech, ale je schopen vytvářet tuhé roztoky - slitiny, například se železem.
Chemické vlastnosti uhlíku
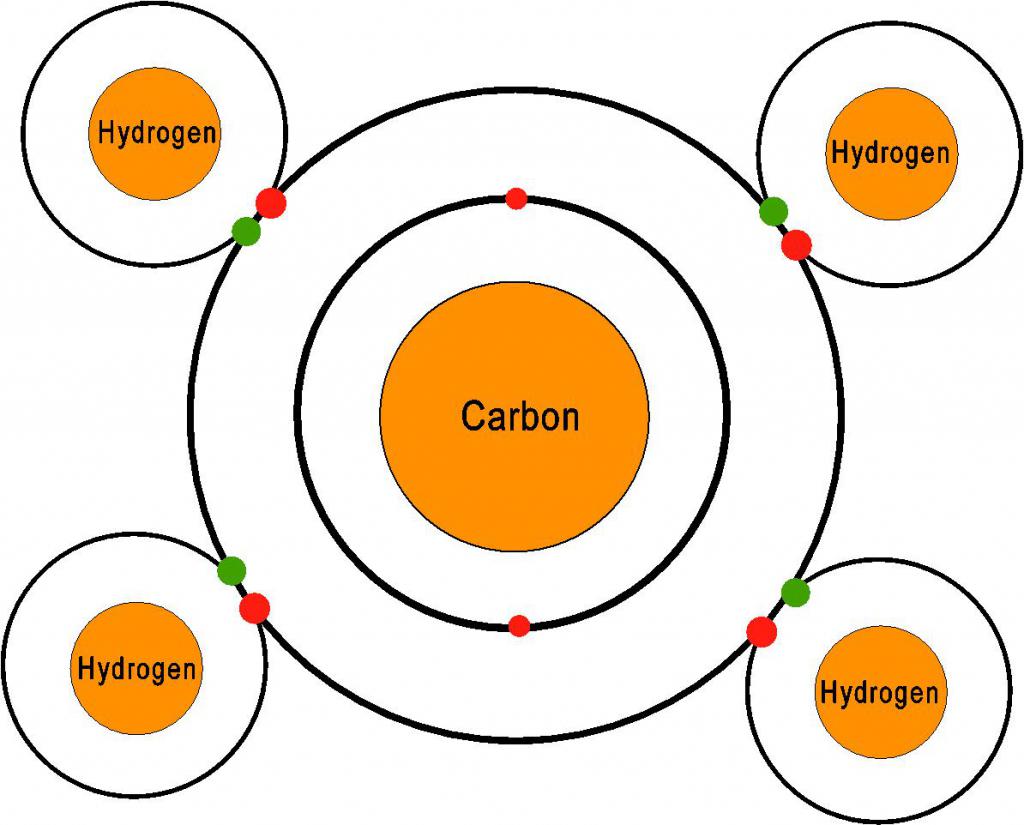
V závislosti na látce, s níž uhlík reaguje, může vykazovat dvojí vlastnosti: jak redukční činidlo, tak oxidační činidlo. Například, fusing koksu s kovy, dostat jejich sloučeniny - karbidy. V reakci s vodíkem se tvoří uhlovodíky. To je organických sloučenin například methan, ethylen, acetylen, ve kterém, jako v případě kovů, má uhlík oxidační stav rovnající se -4. Redukční chemické reakce uhlíku, jehož vlastnosti studujeme, se projevují při interakci s kyslíkem, halogeny, vodou a základní oxidy.
Oxidy uhlíku
Spalování uhlí v nízkém obsahu kyslíku produkuje oxid uhelnatý, bivalentní oxid uhličitý. Je bezbarvý, bez zápachu a vysoce toxický. V kombinaci s hemoglobinem v krvi při dýchání se oxid uhelnatý rozšiřuje po celém lidském těle, což způsobuje otravu a následnou smrt. Při klasifikaci látka nahrazuje indiferentní oxidy, nereaguje s vodou, neodpovídá ani zásadě ani kyselině. Chemické vlastnosti uhlíku s valencí 4 se liší od dříve zvažované charakteristiky.
Oxid uhličitý
Bezbarvá plynná látka při teplotě 15 ° C a tlaku jedné atmosféry se změní na pevnou fázi. Říká se tomu suchý led. C02 molekuly jsou nepolární, i když kovalentní vazba mezi atomy kyslíku a uhlíkem je polární. Spojení se týká oxidů kyselin. V interakci s vodou vytváří kyselinu uhličitanu. Existují reakce mezi oxidem uhličitým a jednoduchými látkami: kovy a nekovy, například s hořčíkem, vápníkem nebo koksem. V nich hraje roli oxidačního činidla.
Kvalitní reakce na oxid uhličitý
Aby se zajistilo, že zkušební plyn je skutečně oxid uhelnatý CO 2 , provádí se následující experiment v anorganické chemii: látka se vede přes čirý roztok vápene. Pozorování zakalení roztoku způsobené vysrážením bílé sraženiny uhličitanu vápenatého potvrzuje přítomnost molekul oxidu uhličitého v reakční směsi. Po dalším průchodu plynu roztokem hydroxidu vápenatého se precipitát CaCO3 rozpouští v důsledku jeho přeměny na hydrogenuhličitan vápenatý, ve vodě rozpustnou sůl.

Úloha uhlíku v procesu domény
Chemické vlastnosti uhlíku se používají v průmyslové výrobě železa ze svých rud: magnetické, červené nebo hnědé železné rudy. Hlavním z nich budou redukční vlastnosti uhlíku a oxidů - oxid uhelnatý a oxid uhelnatý oxid uhličitý. Procesy, které se vyskytují ve vysoké peci, mohou být reprezentovány jako následující sled reakcí:
- Nejprve koks spaluje v proudu vzduchu ohřátém na 1850 ° C za vzniku oxidu uhličitého: C + O 2 = CO 2 .
- Při průchodu horkým uhlíkem se redukuje na oxid uhelnatý: CO 2 + C = 2CO.
- Oxid uhelnatý reaguje s železnou rudou, což vede k oxidům železa: 3Fe 2 O 3 + CO = 2Fe 3 O 4 + CO 2 ↑, Fe 3 O 4 + CO = 3FeO + CO 2 .
- Reakce získání železa bude mít následující formu: FeO + CO = Fe + C02
Roztavené železo samo o sobě rozpouští směs uhlíku a oxidu uhelnatého, ukáže se jako látka - cementite.

Železo, tavené ve vysoké peci, s výjimkou železa, obsahuje až 4,5% uhlíku a dalších nečistot: mangan, fosfor, síru. Ocel, která se liší od litiny řadou vlastností, například její schopnost válcování a kování, má ve svém složení pouze 0,3 až 1,7% uhlíku. Výrobky z oceli jsou široce používány téměř ve všech odvětvích: strojírenství, metalurgie, lékařství.
V našem článku jsme zjistili, jaké chemické vlastnosti uhlíku a jeho sloučenin se používají v různých sférách lidské činnosti.