Oxid draselný: vzorec, interakce
V anorganické chemii existují tři hlavní skupiny sloučenin. Jsou to kyseliny, alkálie a oxidy. Kyselina sestává z kationtu vodíku a aniontu z kyselého zbytku. Alkalická sloučenina je z kovového kationtu a hydroxylové skupiny. O oxidech budeme podrobněji diskutovat níže.
Co je oxid?
Tato sloučenina se skládá ze dvou různých chemických prvků, z nichž jeden je kyslík. Druhá může být kovová nebo nekovová. Počet atomů kyslíku závisí na valence druhého chemického prvku, který je součástí sloučeniny. Například valence draslíku se rovná jedné, proto oxid draselný bude obsahovat jeden atom kyslíku a dva atomy draslíku. Vážení vápníku je dva, takže jeho oxid bude sestávat z jednoho atomu kyslíku a jednoho atomu vápníku. Vliv fosforu je pět, takže jeho oxid se skládá ze dvou atomů fosforu a pěti atomů kyslíku.
Ad
V tomto článku budeme mluvit více o oxidu draselném. Konkrétně - o jeho fyzikálních a chemických vlastnostech, o použití v různých průmyslových odvětvích. 
Oxid draselný: Vzorec
Vzhledem k tomu, že valence tohoto kovu je jeden a válec kyslíku je dva, bude tato chemická sloučenina sestávat ze dvou atomů kovu a jednoho atomu kyslíku. Takže, oxid draselný: vzorec - K 2 O. 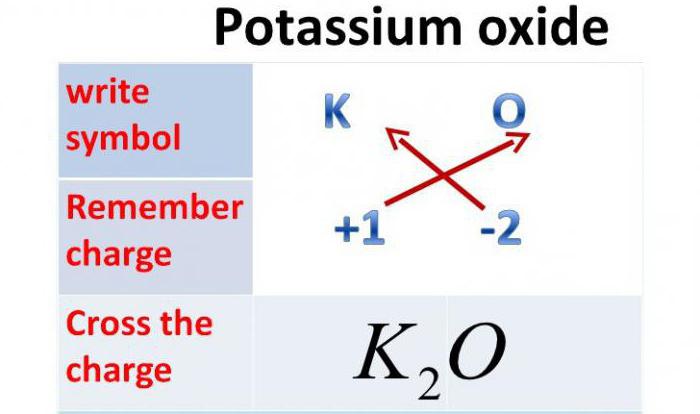
Fyzikální vlastnosti
Uvažovaný oxid má bledě žlutou barvu. Někdy může být bezbarvá. Při pokojové teplotě má agregaci v pevném stavu.
Bod tání této látky je 740 stupňů Celsia.
Hustota je 2,32 g / cm3.
Tepelný rozklad tohoto oxidu produkuje peroxid stejného kovu a čistého draslíku.
Rozpustný v organických rozpouštědlech.
Ne rozpouští se ve vodě, ale reaguje s ní.
Je vysoce hygroskopická.
Chemické vlastnosti K 2 O
Tato látka má chemické vlastnosti typické pro všechny základní oxidy. Zvažte chemické reakce tohoto oxidu s různými látkami.
Reakce s vodou
Nejprve je schopen reagovat s vodou s tvorbou hydroxidu kovu.
Rovnice pro tuto reakci je následující:
- K 2 O + H 2 O = 2KON
Vzhledem k molární hmotnosti každé látky lze z rovnice vyvodit následující závěr: 112 gramů hydroxidu draselného lze získat z 94 gramů oxidu a 18 gramů vody.
S dalšími oxidy
Kromě toho může tento oxid reagovat s oxidem uhličitým. (oxid uhličitý). To vytváří sůl - draselný uhličitan. 
Rovnici pro reakci oxidu draselného a oxidu uhličitého lze psát následovně:
- K20 + CO2 = K2C03
Dá se tedy dospět k závěru, že ze 94 gramů příslušného oxidu a 44 gramů oxidu uhličitého se získá 138 gramů uhličitan draselný.
Také zvažovaný oxid může reagovat s oxidem siřičitým. Toto tvoří další sůl - síran draselný.
Interakce oxidu draselného s oxidem síry může být vyjádřena následující rovnicí:
- K 2O + SO 3 = K 2SO 4
Ukazuje se, že 94 g oxidu a 80 g oxidu síry lze získat 174 g síranu draselného.
Stejným způsobem může K 2 O reagovat s jinými oxidy.
Dalším typem interakce jsou reakce, které nejsou s kyselinou, ale s amfoterní oxidy. V tomto případě se nejedná o kyselinu, která se tvoří, ale o sůl. Příkladem takového chemického procesu je interakce dotyčného oxidu s oxidem zinečnatým.
Ad
Tato reakce může být vyjádřena následující rovnicí:
- K 2O + ZnO = K 2 ZnO 2
Ukazuje se, že během interakce dotyčného oxidu a oxidu zinečnatého vzniká sůl zinku. Pokud znáte molární hmotnost všech látek, pak můžete vypočítat, že ze 94 gramů K 2 O a 81 gramů oxidu zinečnatého získáte 175 gramů zinku draselného.
Také K 2 O je schopen interagovat s oxidem dusíku. To tvoří směs dvou solí: dusičnan a dusičnan draselný. Rovnice pro tuto reakci vypadá takto:
- K 2O + 2NO 2 = KNO 3 + KNO 2
Znáte-li molekulární hmoty látek, můžeme říci, že z 94 gramů příslušného oxidu a 92 gramů oxidu dusíku lze získat 101 gramů dusičnanu a 85 gramů dusitanu. 
Interakce s kyselinami
Nejběžnějším případem je oxid draselný + kyselina sírová = síran draselný + voda. Reakční rovnice vypadá takto:
- K 2O + H 2SO 4 = K 2SO 4 + H 2O
Z rovnice lze usoudit, že k získání 174 gramů síranu draselného a 18 gramů vody se musí vzít 94 gramů příslušného oxidu a 98 gramů kyseliny sírové.
Podobně dochází k chemické interakci mezi daným oxidem a kyselinou dusičnou. To vytváří dusičnan draselný a vodu. Rovnici pro tuto reakci lze psát následovně:
Ad
- 2K 2O + 4HNO 3 = 4KNO 3 + 2H 2O
Z 188 gramů uvedeného oxidu a 252 gramů kyseliny dusičné lze tedy získat 404 gramů dusičnanu draselného a 36 gramů vody.
Stejným principem může zvažovaný oxid reagovat s jinými kyselinami. Během procesu se vytvoří další soli a voda. Tak například při reakci tohoto oxidu s kyselina fosforečná fosfát a voda, kyselina chlorovodíková a voda, chlorid a tak dále. 
K 2 O a halogeny
Uvažovaná chemická sloučenina může také reagovat s látkami této skupiny. Halogeny zahrnují jednoduché sloučeniny složené z několika atomů stejného chemického prvku. To je například chlor, brom, jod a některé další.
Ad
Takže chlór a draselný: rovnice:
- K 2 O + C 2 2 = KCl + KCÍO
Výsledkem této interakce jsou dvě soli: chlorid draselný a chlornan. Ze 94 gramů příslušného oxidu a 70 gramů chloru se získá 74 gramů chloridu draselného a 90 gramů chlornanu draselného.
Amoniakální reakce
K 2 O je schopen reagovat s touto látkou. V důsledku této chemické interakce vzniká hydroxid draselný a amid. Rovnice pro tuto reakci je následující:
- K20 + NH3 = KOH + KNH2
Známe molární masy všech látek, můžeme vypočítat poměr reakčních činidel a reakčních produktů. Ze 94 gramů uvedeného oxidu a 17 gramů amoniaku lze získat 56 gramů hydroxidu draselného a 55 gramů amidu draselného.
Interakce s organickými látkami
Z organických chemikálií reaguje oxid draselný s ethery a alkoholy. Tyto reakce jsou však pomalé a vyžadují zvláštní podmínky.
Získání K 2 O
Tuto chemickou látku lze získat několika způsoby. Zde jsou nejčastější:
- Z dusičnanu draselného a kovového draslíku. Tato dvě činidla se zahřívají, což vede k tvorbě K20 a dusíku. Reakční rovnice je následující: 2KNO 3 + 10K = N 2 + 6K 2 O.
- Druhá metoda se objevuje ve dvou fázích. Nejprve dochází k reakci mezi draslíkem a kyslíkem, což vede k tvorbě peroxidu draselného. Reakční rovnice vypadá takto: 2K + O 2 = K 2 O 2 . Peroxid je dále obohacen draslíkem, což vede k získání oxidu draselného. Reakční rovnice může být zapsána následovně: K 2 O 2 + 2K = 2K 2 O.

Použití K 2 O v průmyslu
Nejčastěji zvažovaná látka se používá v zemědělském průmyslu. Tento oxid je jednou ze složek minerálních hnojiv. Draslík je pro rostliny velmi důležitý, protože zvyšuje jejich odolnost vůči různým chorobám. Uvažovaná látka se také používá ve stavebnictví, neboť může být přítomna ve složení určitých druhů cementu. Kromě toho se v chemickém průmyslu používá k výrobě dalších sloučenin draslíku.