Stupeň oxidace dusíku v amoniaku
Existují chemické prvky vykazující různé stupně oxidace, které umožňují vytvářet velké množství sloučenin s určitými vlastnostmi během chemických reakcí. Pokud známe elektronickou strukturu atomu, můžeme předpokládat, které látky budou tvořeny. 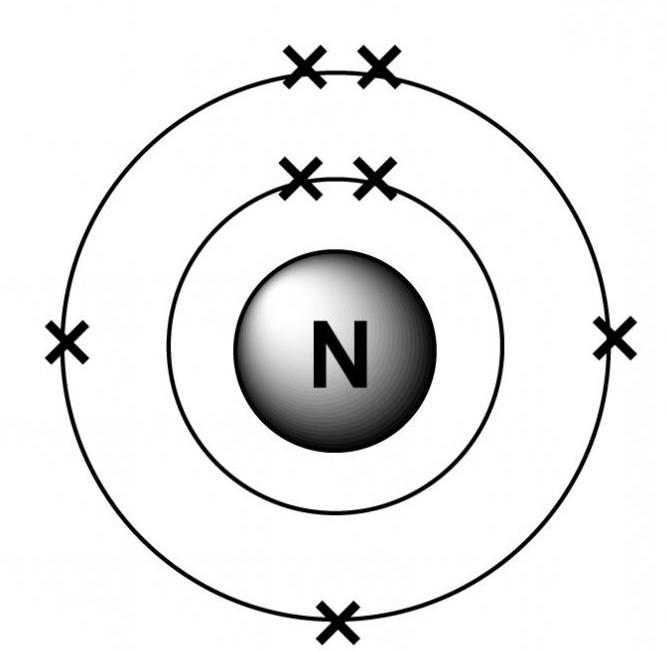
Stupeň oxidace dusíku se může měnit od -3 do +5, což signalizuje rozmanitost sloučenin na něm založených.
Prvek funkce
Dusík patří k chemickým prvkům, které se nacházejí v 15. skupině, v druhé periodě v periodické tabulce D. Mendeleeva. Je mu přiřazeno sériové číslo 7 a zkrácené písmeno N. Za normálních podmínek, relativně inertního prvku, jsou nezbytné zvláštní podmínky pro provádění reakcí.
V přírodě se vyskytuje ve formě diatomického bezbarvého plynu atmosférického vzduchu s objemovým podílem více než 75%. Obsahuje se ve složení proteinových molekul, nukleových kyselin a dusíkaté anorganické látky původu.
Atomová struktura
Určit oxidační stav dusíku ve sloučeninách, je nutné znát jeho jadernou strukturu a studovat elektronové skořápky.
Přírodním prvkem jsou dva stabilní izotopy s hmotnostním číslem 14 nebo 15. První jádro obsahuje 7 neutronových a 7 protonových částic a druhé obsahuje 1 další neutronové částice.
Existují umělé odrůdy svého atomu s hmotností 12-13 a 16-17, s nestabilními jádry.
Při studiu elektronické struktury atomového dusíku je zřejmé, že existují dvě elektronové skořepiny (vnitřní a vnější). 1s orbitaly obsahují jeden pár elektronů. 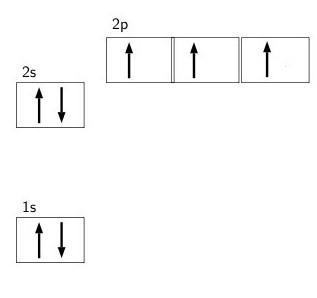
Na druhém vnějším plášti se nachází pouze pět negativně nabitých částic: dva na dvousložkách a tři na 2p-orbitalu. Úroveň energie valence nemá volné buňky, což naznačuje nemožnost oddělení jejího elektronového páru. 2p orbital je považován za napůl naplněný elektrony, což umožňuje připojit 3 negativně nabité částice. V tomto případě je stupeň oxidace dusíku -3.
Vzhledem k struktuře orbitálů lze usoudit, že tento prvek s koordinačním číslem 4 je maximálně spojen pouze se čtyřmi dalšími atomy. Pro tvorbu tří vazeb se používá výměnný mechanismus, jiný je tvořen metodou donor-akceptor.
Oxidace dusíku v různých sloučeninách
Maximální počet negativních částic, které je atom schopen připojit, je 3. V tomto případě je stupeň jeho oxidace rovný -3, charakteristický pro sloučeniny jako NH3 nebo amoniak, NH4 + nebo amonium a nitridy Me3N2. Tyto látky se vytvářejí se zvyšující se teplotou reakcí dusíku s kovovými atomy.
Největší počet záporně nabitých částic, které je prvek schopen dát, je 5.
Dva atomy dusíku se mohou vzájemně kombinovat za vzniku stabilních sloučenin s oxidačním stavem -2. Tato vazba je pozorována v N2H4 nebo hydrazinech, v azidech různých kovů nebo MeN3. Dusíkový atom připojuje dva elektrony k volným orbitalům.
Existuje oxidační stav -1, když tento prvek přijímá pouze 1 zápornou částic. Například v NH2OH nebo hydroxylaminu je záporně nabitá.
Existují pozitivní náznaky stupně oxidace dusíku, kdy jsou částice elektronů odebírány z vnější energetické vrstvy. Oni se pohybují od +1 do +5. 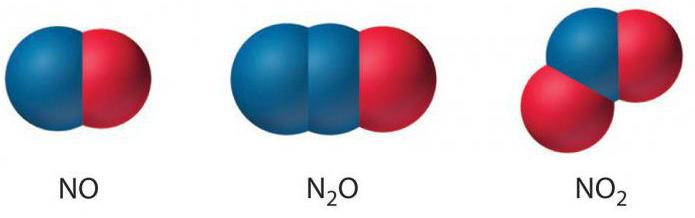
Náboj 1+ je přítomen v dusíku v N 2 O (monovalentní oxid) a v hyonitritu sodíku vzorce Na2N2O2.
V NO (dvojmocný oxid) se prvek vzdálí dvěma elektronům a je kladně nabit (+2).
Existuje stupeň oxidace dusíku 3 (ve sloučenině NaNO 2 nebo nitridu a také v trojmocném oxidu). V tomto případě se oddělují 3 elektrony.
Nabití +4 se děje v oxidu s valencí IV nebo jeho dimerem (N 2 O 4 ).
Pozitivní znak oxidačního stavu (+5) se objevuje v N 2 O 5 nebo v pentavalentním oxidu, v kyselina dusičná a jeho derivátové soli.
Sloučeniny z dusíku s vodíkem
Přírodní látky na základě výše uvedených dvou prvků připomínají organické uhlovodíky. Pouze dusičnanový vodík ztrácí svou stabilitu, když se zvyšuje množství atomového dusíku. 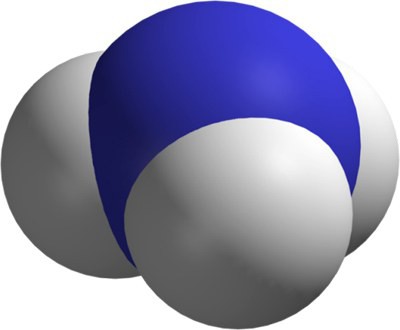
Mezi nejvýznamnější vodíkové sloučeniny patří amoniak, hydrazin a kyselina hydrazoová. Získávají se reakcí vodíku s dusíkem a v posledně uvedeném případě také kyslík.
Co je amoniak
Označuje se také jako nitrid vodíku a jeho chemický vzorec je označen jako NH3 o hmotnosti 17. V podmínkách normální teploty a tlaku má amoniak formu bezbarvého plynu se silným zápachem podobným amoniaku. Hustota je 2krát menší než vzduch, snadno se rozpouští ve vodním prostředí kvůli polární struktuře molekuly. Léčí látky s nízkým nebezpečím.
V průmyslových objemech se amoniak získává katalytickou syntézou z molekul vodíku a dusíku. Existují laboratorní metody pro získání dusitanů z amonných solí a sodíku.
Struktura amoniaku
Ve složení pyramidové molekuly je jeden atom dusíku a 3 atomy vodíku. Jsou umístěny relativně vůči sobě pod úhlem 107 stupňů. V molekule ve tvaru tetrahedronu je dusík centrován. Kvůli třem nepárovým p-elektronům je spojen kovalentními polárními vazbami se 3 atomy vodíku, které mají každý 1 s-elektron. Tak se vytvoří molekula amoniaku. V tomto případě má dusík oxidační stav -3. 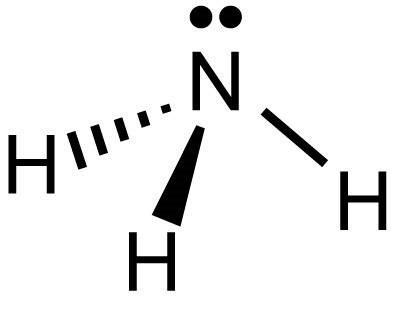
Tento prvek je stále osamělý pár elektronů na vnější úrovni, který vytváří kovalentní vazbu s iontem vodíku, který má kladný náboj. Jeden prvek je dárcem negativně nabitých částic a druhý je akceptor. Toto tvoří amonný iont NH4 + .
Co je amonium
Je označován jako kladně nabité polyatomové ionty nebo kationty. Amoniak je také považován za chemickou látku, která nemůže existovat ve formě molekuly. Skládá se z amoniaku a vodíku.
Amoniak s kladným nábojem v přítomnosti různých aniontů se záporným znaménkem je schopen tvořit amonné soli, ve kterých se chová jako kovy s valencí I. Je také s jeho účastí syntetizovány sloučeniny amonné.
Mnoho amonných solí existuje jako krystalické, bezbarvé látky, které se dobře rozpouštějí vodou. Pokud jsou sloučeniny iontů NH4 + tvořeny těkavými kyselinami, pak za podmínek zahřívání rozkládají a uvolňují plynné látky. Jejich následné chlazení vede k reverzibilnímu procesu.
Stabilita těchto solí závisí na síle kyselin, ze kterých jsou vytvořeny. Stabilní amoniové sloučeniny odpovídají silnému kyselému zbytku. Například se vyrábí stabilní chlorid amonný kyselina chlorovodíková. Při teplotách do 25 stupňů se tato sůl nerozkládá, což nelze říci o uhličitanu amonném. Tato druhá sloučenina se často používá při vaření pro zvedání těsta, nahrazující sódu na pečení.
Cukrovinky na bázi uhličitanu amonného se nazývají prostě amonia. Tuto sůl využívají pivovary ke zlepšení fermentace pivovarských kvasnic. 
Kvalitativní reakcí pro detekci amonných iontů je působení hydroxidů alkalických kovů na jeho sloučeniny. V přítomnosti NH4 + se uvolňuje amoniak.
Chemická struktura amoniaku
Konfigurace jeho iontů připomíná pravidelný čtverec s dusíkem ve svém středu. V horní části obrázku jsou umístěny atomy vodíku. Chcete-li vypočítat stupeň oxidace dusíku v amoniaku, musíte si uvědomit, že celkový náboj kationu je +1 a každý vodíkový ion má jeden elektron, ale je pouze 4. Celkový vodíkový potenciál je +4. Pokud odečteme náboj všech iontů vodíku z kationtového náboje, dostaneme: +1 - (+4) = -3. To znamená, že dusík má oxidační stav -3. V tomto případě připojí tři elektrony.
Co jsou nitridy
Dusík je schopen kombinovat s elektropozitivními atomy kovové a nekovové povahy. Výsledkem jsou sloučeniny podobné hydridům a karbidům. Takové látky obsahující dusík se nazývají nitridy. Mezi kovem a atomem dusíku v těchto sloučeninách se vyskytují kovalentní, iontové a meziprodukty. Tato charakteristika je základem jejich zařazení.
Kovalentní nitridy zahrnují sloučeniny v chemické vazbě, jejichž elektrony se nepřenášejí z atomového dusíku, ale společně s negativně nabitými částicemi jiných atomů tvoří společný elektronový oblak.
Příklady takových látek jsou nitridy vodíku, jako jsou molekuly amoniaku a hydrazinu, jakož i halogenidy dusíku, které zahrnují chloridy, tribromidy a fluorididy. Sdílí společný elektronový pár patří stejně k dvěma atomům.
Mezi nitridy iontů patří sloučeniny s chemickou vazbou vytvořené přechodem elektronů z kovového prvku na volné hladiny dusíku. V molekulách těchto látek je pozorována polarita. Nitridy mají stupeň oxidace dusíku 3-. Proto bude celkový náboj kovu 3+. 
Takové sloučeniny zahrnují nitridy hořčíku, lithia, zinku nebo mědi, s výjimkou alkalických kovů. Mají vysokou teplotu tání.
Nitridy s mezilehlou vazbou zahrnují látky, v nichž jsou atomy kovů a dusíku rovnoměrně rozloženy a není jasné vysídlení elektronového mraku. K těmto inertním sloučeninám patří nitridy ze železa, molybdenu, manganu a wolframu.
Popis oxidu železitého
Také se nazývá anhydrid, získaný z kyseliny dusité mající vzorec HNO2. Vzhledem k stupni oxidace dusíku (3+) a kyslíku (2-) v trioxidu se získá poměr atomů prvků 2 k 3 nebo N 2 O 3 .
Kapalné a plynné formy anhydridu jsou vysoce nestabilní sloučeniny, snadno se rozkládají na 2 různé oxidy s valencími IV a II.